
【题目】实验室进行二氧化硫制备与性质实验的组合装置如图所示,部分夹持装置未画出。

请回答下列问题:
(1)在组装好装置后,首先要进行的实验操作为_________________________________。
(2)为检验SO2与Na2O2的反应是否有氧气生成,装置B中盛放的试剂X应为________,装置D中碱石灰的作用是_______________________________________________。
(3)关闭弹簧夹2,打开弹簧夹1,注入70%的硫酸至浸没三颈烧瓶中的固体,检验SO2与Na2O2反应是否有氧气生成的操作及现象是_____________________________________。
(4)关闭弹簧夹1,打开弹簧夹2,残余气体进入装置E、F、G中,能说明I-的还原性弱于SO2的现象为_________________。发生反应的离子方程式是______________________。
(5)为了验证装置E中SO2与FeCl3发生了氧化还原反应,某学生设计了如下实验:取少量装置E中的溶液于试管中,向其中加入稀硝酸酸化的BaCl2溶液,产生白色沉淀,并由此判断SO2与FeCl3发生了氧化还原反应。上述方案是否合理?________(填“合理”或“不合理”),原因是________。
【答案】 检查装置的气密性 浓硫酸 吸收未反应的SO2,防止污染空气,同时防止空气中的水蒸气进入装置与Na2O2反应,干扰实验 将带火星的木条放在干燥管D出口处,若木条复燃,则有氧气生成,否则无氧气生成 装置F中溶液蓝色褪去 SO2+I2+2H2O===2I-+SO![]() +4H+ 不合理 装置E中溶液溶解的SO2可被稀硝酸氧化成SO
+4H+ 不合理 装置E中溶液溶解的SO2可被稀硝酸氧化成SO![]() ,也可与BaCl2反应,生成白色沉淀,会对SO2与FeCl3反应产物(SO
,也可与BaCl2反应,生成白色沉淀,会对SO2与FeCl3反应产物(SO![]() )的检验造成干扰
)的检验造成干扰
【解析】由题意结合流程,A为SO2的制取装置;B为吸水装置,防止水蒸气与Na2O2反应,干扰SO2与Na2O2反应的实验探究;C为SO2与Na2O2反应装置;D为隔绝空气及尾气吸收装置;E、F为探究SO2还原性的装置;G为尾气吸收装置。
(1)有气体参与或生成的实验装置组装好后的第一步操作都是检查装置的气密性。
(2)因为Na2O2能与水蒸气反应产生氧气,所以要检验SO2与Na2O2反应是否有氧气生成,为避免干扰,应先除去水蒸气;SO2是有毒的酸性氧化物,可用碱石灰吸收,以防止污染,同时碱石灰可防止空气中的水蒸气、CO2进入装置与Na2O2反应,干扰实验。
(3)检验氧气用带火星的木条,木条复燃则证明有氧气生成。
(4)关闭弹簧夹1,打开弹簧夹2,SO2气体进入装置E、F、G中,若装置F中溶液蓝色褪去,则说明I-的还原性弱于SO2;发生反应的离子方程式是SO2+I2+2H2O=2I-+SO42-+4H+。
(5)评价该实验方案时,要考虑检验试剂与原溶液中所含物质的反应是否会对实验造成干扰。装置E中溶液溶解的SO2可被稀硝酸氧化成SO42-,也可与BaCl2反应,生成白色沉淀,会对SO2与FeCl3反应产物(SO42-)的检验造成干扰,所以该同学的方案不合理。


科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. SO2可以用来漂白纸浆、毛、丝、草帽辫,增白食品等
B. 糖类、油脂和蛋白质在一定条件下都能水解
C. 汽车尾气中含有的氮氧化物,是汽油不完全燃烧造成的
D. 高锰酸钾溶液、次氯酸钠溶液、双氧水都能杀菌消毒,这是利用他们的强氧化性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】t ℃时,在体积不变的密闭容器中发生反应:X(g)+3Y(g)![]() 2Z(g),各组分在不同时刻的浓度如下表:
2Z(g),各组分在不同时刻的浓度如下表:
物质 | X | Y | Z |
初始浓度/(mol·L-1) | 0.1 | 0.2 | 0 |
2 min末浓度/(mol·L-1) | 0.08 | a | b |
平衡浓度/(mol·L-1) | 0.05 | 0.05 | 0.1 |
下列说法正确的是( )
A. 平衡时,X的转化率为20%
B. 2 min时Y的物质的量为0.14
C. 增大平衡后的体系压强,v(正)增大,v(逆)减小
D. 2 min内,用Y的变化量表示的平均反应速率v(Y)=0.03 mol·L―1·min―1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从某含有FeCl2、FeCl3、CuCl2的工业废液中回收铜并制备氯化铁晶体的流程如下:则下列说法正确的是
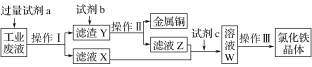
A. 试剂a是铁、试剂b是稀硫酸
B. 操作Ⅰ、操作Ⅱ、操作Ⅲ所用仪器相同
C. 试剂c是氯气,相应的反应为: 2Fe2++Cl2===2Cl-+2Fe3+
D. 用酸性KMnO4溶液可检验溶液W中是否还有Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质的性质与用途不对应的是( )
A. 铝合金的密度小,硬度大,可用作建筑材料
B. 食品工业中用Na2CO3作焙制糕点的膨松剂
C. FeCl3溶液能与Cu反应,可用于腐蚀铜制印刷电路板
D. 二氧化硅是制造光导纤维的材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是制取溴苯的装置。回答下列问题:
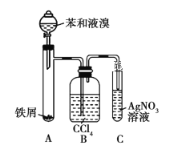
(1)装置A中发生反应的化学方程式是______________、______________。
(2)装置C中观察到的现象是______________,证明____________。
(3)装置B是吸收瓶,瓶内盛有CCl4,实验中观察到的现象是_________________,原因是___________________;如果没有装置B,将装置A、C直接相连,则该套实验装置_________(填“合理”或“不合理”),原因是___________。
(4)实验完毕后,将装置A试管中的液体倒入盛有冷水的烧杯中,烧杯_______(填“下”或“上”)层为溴苯。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有反应:mA (g) +nB (g)![]() pc (g) ,达到平衡后,当升高溫度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:
pc (g) ,达到平衡后,当升高溫度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:
(1)该反应的逆反应为____热反应,且m+n____p (填“>”、 “=” 、“<”)。
(2)减压时,A的质量分数______.(填“增大”、“减小”或“不变”,下同)
(3)若加入B (体积不变),则A的转化率_____,B的转化率_________。
(4)若升高溫度,则平衡时B、C的浓度之比将__________。
(5)若加入催化剂,平衡时气体混合物的总物质的量______________。
(6)若B是有色物质,A、C均无色,则加入C (体积不变)时混合物颜色______,而维持容器内压强不变,充入氖气时,混合物颜色______(填“变深”、 “变浅”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用铁、铝的混合物进行如下实验:

(1)操作X的名称是___________。
(2)气体A是___________。
(3)加入足量NaOH 溶液时发生反应的离子方程式为______________;加入盐酸发生反应的离子方程式为_______________。
(4)溶液B 中阴离子除OH-外还有_________,溶液D中存在的金属离子为___________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯直接水合法制乙醇因污染小而应用于工业合成,下列有关说法错误的是( )
A. 该反应属于加成反应
B. 乙烯能使酸性KMnO4溶液褪色
C. 乙烷中含有少量乙烯,可用H2除去
D. 等物质的量的乙烯与乙醇充分燃烧,耗氧量相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com