
【题目】t ℃时,在体积不变的密闭容器中发生反应:X(g)+3Y(g)![]() 2Z(g),各组分在不同时刻的浓度如下表:
2Z(g),各组分在不同时刻的浓度如下表:
物质 | X | Y | Z |
初始浓度/(mol·L-1) | 0.1 | 0.2 | 0 |
2 min末浓度/(mol·L-1) | 0.08 | a | b |
平衡浓度/(mol·L-1) | 0.05 | 0.05 | 0.1 |
下列说法正确的是( )
A. 平衡时,X的转化率为20%
B. 2 min时Y的物质的量为0.14
C. 增大平衡后的体系压强,v(正)增大,v(逆)减小
D. 2 min内,用Y的变化量表示的平均反应速率v(Y)=0.03 mol·L―1·min―1
【答案】D
【解析】
试题 X + 3Y![]() 2Z
2Z
初始浓度(molL1) 0.1 0.2 0
转化浓度(molL1)0.05 0.15 0.1
平衡浓度(molL1)0.05 0.05 0.1
A、平衡时,X的转化率=0.05mol/L÷0.1mol/L×100%=50%,A错误;B、2mim消耗X是0.02mol/L,则消耗Y是0.06mol/L,所以剩余Y是0.14mol/L,B错误;C、增大平衡后的体系压强,正反应速率、逆反应速率都增大,C错误;D、前2 min内,用Y的变化量表示的平均反应速率v(Y) =3v(X)=3×(0.1molL1-0.08molL1)÷2min="0.03" mol·L-1·min-1,D正确,答案选D。


科目:高中化学 来源: 题型:
【题目】利用核磁共振技术测定有机物分子的三维结构的研究曾获得诺贝尔化学奖。在有机物分子中,不同位置的氢原子的核磁共振氢谱中给出的峰值(信号)也不同。根据峰值(信号)可以确定有机物分子中氢原子的种类和数目。
例如:乙醚的结构式为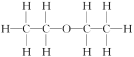 ,其核磁共振氢谱中有2个峰(信号)(参见下图)。
,其核磁共振氢谱中有2个峰(信号)(参见下图)。
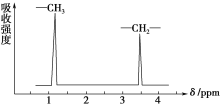
CH3CH2OCH2CH3的核磁共振氢谱
(1)下列分子中,其核磁共振氢谱中只有一种峰(信号)的物质是________。
A.CH3CH3 B.CH3COOH C.CH3COOCH3 D.CH3COCH3
(2)化合物A和B的分子式都是C2H4Br,A的核磁共振氢谱如图所示,则A的结构简式为________,请预测B的核磁共振氢谱上有________个峰(信号)。
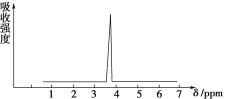
A的核磁共振氢谱示意图
(3)用核磁共振氢谱的方法来研究C2H6O的结构,请简要说明根据核磁共振氢谱的结果来确定C2H6O分子结构的方法是_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20ml,0.1mol·L-1CH3COOH溶液中滴加0.1mol·L-1的NaOH溶液,其pH变化曲线如图所示(忽视温度变化)。下列说法中错误的是

A. c点表示CH3COOH和NaOH恰好反应完全
B. a点表示的溶液中由水电离出的H+浓度为1.0×10-11mol·L-1
C. b点表示的溶液中c(CH3COO-)>c(Na+)
D. b、d点表示的溶液中[c(CH3COO-)c(H+)]/c(CH3COOH)相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于离子化合物和共价化合物的说法正确的是( )
A.共价化合物中可能含离子键
B.离子化合物中可能不含金属元素
C.共价化合物溶于水不能导电
D.第ⅠA族元素与第ⅦA族元素形成的化合物一定是离子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设nA为阿伏伽德罗常数的数值,下列说法正确的是
A. 23g Na 与足量H2O反应完全后可生成nA个H2分子
B. 1 molCu和足量热浓硫酸反应可生成nA个SO3分子
C. 标准状况下,22.4L N2和H2混合气中含nA个原子
D. 3mol单质Fe完全转变为Fe3O4,失去8nA个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验所述的变化过程与氧化还原反应无关的是
A | B | C | D | |
实验 | NaOH 溶液滴入FeSO4 溶液中 | 石蕊溶液滴入氯水中 | 向 K2Cr2O7 溶液 中滴加浓硫酸 | CO2 通入 Na2O2 |
现象 | 产生白色沉淀,最 终变为红褐色 | 溶液变红,随后迅速褪色 | 溶液黄色变浅, 橙色加深 | 固体逐渐变白 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H是一种性能优异的高分子材料,其结构简式为:
![]()
已被广泛应用于声、热、光的传感等方面。它是由CH≡CH、(CN)2、CH3COOCHCH=CH2三种单体通过适当反应形成的。由H的结构简式分析合成过程中发生反应的类型是:①加成反应;②取代反应;③缩聚反应; ④加聚反应 ( )
A. ①② B. ①③ C. ①④ D. ①②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室进行二氧化硫制备与性质实验的组合装置如图所示,部分夹持装置未画出。

请回答下列问题:
(1)在组装好装置后,首先要进行的实验操作为_________________________________。
(2)为检验SO2与Na2O2的反应是否有氧气生成,装置B中盛放的试剂X应为________,装置D中碱石灰的作用是_______________________________________________。
(3)关闭弹簧夹2,打开弹簧夹1,注入70%的硫酸至浸没三颈烧瓶中的固体,检验SO2与Na2O2反应是否有氧气生成的操作及现象是_____________________________________。
(4)关闭弹簧夹1,打开弹簧夹2,残余气体进入装置E、F、G中,能说明I-的还原性弱于SO2的现象为_________________。发生反应的离子方程式是______________________。
(5)为了验证装置E中SO2与FeCl3发生了氧化还原反应,某学生设计了如下实验:取少量装置E中的溶液于试管中,向其中加入稀硝酸酸化的BaCl2溶液,产生白色沉淀,并由此判断SO2与FeCl3发生了氧化还原反应。上述方案是否合理?________(填“合理”或“不合理”),原因是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】右下表为元素周期表的一部分,其中X、Y、Z、W为短周期元素,W元素的核电荷数为X元素的2倍。下列说法正确的是( )
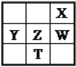
A. X、W、Z元素的原子半径及它们的气态氢化物的热稳定性均依次递增
B. Y、Z、W元素在自然界中均不能以游离态存在,它们的最高价氧化物的水化物的酸性依次递增
C. YX2晶体熔化、液态WX3气化均需克服分子间作用力
D. 根据元素周期律,可以推测T元素的单质具有半导体特性,T2X3具有氧化性和还原性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com