
【题目】利用核磁共振技术测定有机物分子的三维结构的研究曾获得诺贝尔化学奖。在有机物分子中,不同位置的氢原子的核磁共振氢谱中给出的峰值(信号)也不同。根据峰值(信号)可以确定有机物分子中氢原子的种类和数目。
例如:乙醚的结构式为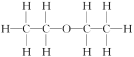 ,其核磁共振氢谱中有2个峰(信号)(参见下图)。
,其核磁共振氢谱中有2个峰(信号)(参见下图)。
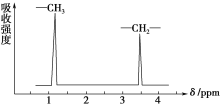
CH3CH2OCH2CH3的核磁共振氢谱
(1)下列分子中,其核磁共振氢谱中只有一种峰(信号)的物质是________。
A.CH3CH3 B.CH3COOH C.CH3COOCH3 D.CH3COCH3
(2)化合物A和B的分子式都是C2H4Br,A的核磁共振氢谱如图所示,则A的结构简式为________,请预测B的核磁共振氢谱上有________个峰(信号)。
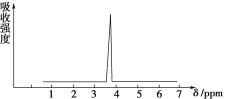
A的核磁共振氢谱示意图
(3)用核磁共振氢谱的方法来研究C2H6O的结构,请简要说明根据核磁共振氢谱的结果来确定C2H6O分子结构的方法是_________________________。
【答案】ADBrCH2CH2Br2通过其核磁共振氢谱中的峰(信号)可以判断有3个峰(信号)时,分子结构为CH3CH2OH;有1个峰(信号)时,分子结构为CH3—O—CH3
【解析】
(1)核磁共振氢谱中只给出一种峰,说明该分子中的H原子都是等效的,只有1种H原子。A.CH3CH3中6个H原子都是等效的,核磁共振氢谱中只给出一种峰,故A正确;B.CH3COOH中甲基中的H原子与羧基中的H原子所处化学环境不同,CH3COOH有2种H原子,核磁共振氢谱中有2个峰,故B错误;C.CH3COOCH3中甲基所处化学环境不同,甲基H原子不同,有2种H原子,核磁共振氢谱中有2个峰,故C错误;D.CH3COCH3中2个甲基连在同一个羰基上,6个H原子都是等效的,核磁共振氢谱中只给出一种峰,故D正确;故选AD;
(2)由A的核磁共振氢谱可知,分子中只有一种H原子,A分子中2个Br原子连接不同的碳原子,故A的结构简式为CH2BrCH2Br,B与A互为同分异构体,B分子中2个Br原子连接在同一碳原子上,B为CH3CHBr2,分子中有2中H原子,故核磁共振氢谱图有2个峰,故答案为:CH2BrCH2Br;2;
(3)通过核磁共振氢谱中的信号峰可以判断有3个信号峰,则为乙醇,分子结构为CH3CH2OH,有1个信号峰时为甲醚,分子结构为CH3OCH3,故答案为:通过其核磁共振谱中的峰信号可以判断,有3个信号时,分子结构为CH3CH2OH;1个信号时,分子结构为CH3-O-CH3。


 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案 期末好成绩系列答案
期末好成绩系列答案科目:高中化学 来源: 题型:
【题目】非金属单质A经如图所示的过程转化为含氧酸D,已知D为强酸,请回答下列问题:
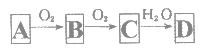
(1)若A在常温下为固体,B是能使品红溶液褪色的有刺激性气味的无色气体。
①D的化学式是_____;
②在工业生产中,B气体的大量排放被雨水吸收后会形成酸雨而污染环境。写出形成酸雨的化学方程式______。工业上常向煤中加入石灰石,减少B气体对环境的污染,其反应的化学方程式为_____。
(2)若A在常温下为气体,C是红棕色的气体。
①A转化为B的化学方程式是____。
②D的稀溶液在常温下可与铜反应并生成B气体,请写出该反应的离子方程式_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“共享单车”,低碳环保,有益健身,方便出行。“最后一公里”,下列关于单车的制造材料说法正确的是( )
A.制造车轮钢圈的材料是合金B.铝合金制造的车架较钢制造的重
C.制造轮胎用的橡胶有固定的熔点D.制作反光板的有机玻璃属于硅酸盐
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金刚烷(C10H16)的结构如图1所示,它可以看成四个等同的六元环组成的空间构型。立方烷(C8H8)的结构如图2所示。其中金刚烷的二氯代物和立方烷的六氯代物的同分异构体分别是 ( )
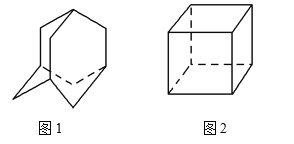
A. 4种和1种 B. 5种和3种
C. 6种和3种 D. 6种和4种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】感光性高分子作为新材料在各种领城中得到广泛应用。感光高分子F的一种合成路线如下:己知:A的相对分子质量为60,核磁共振氢谱显示为两组峰,峰面积比为1∶3。回答下列问题:
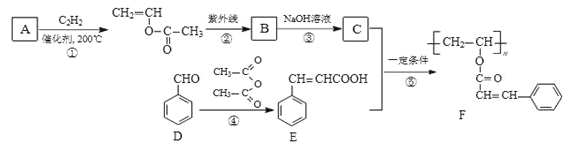
(1)A的结构简式为_______,D的化学名称是____________________。
(2)①、②的反应类型分别是____________________。
(3)反应③的化学方程式是____________________。
(4)F中的官能团有_______________(填官能团名称)。
(5)芳香族化合物G是E的同分异构体,能发生银镜反应且分子中只有4种不同化学环境的氢。写出三种G的结构简式:_____________________________________________。
(6)写出以甲苯为原料(其他无机试剂任选)制备化合物D的合成路线:________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一名同学把4.48 L(已折算成标准状况下)某有机物蒸气在O2中充分燃烧,然后让产物依次通过装有无水CuSO4的干燥管、盛有浓H2SO4的洗气瓶和盛有含0.8 mol Ca(OH)2的澄清石灰水的烧杯,如图所示:
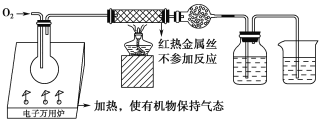
实验结束后发现无水CuSO4变蓝,干燥管和洗气瓶共增重18 g,澄清石灰水变浑浊后又恰好变澄清。请根据实验回答下列问题:
(1)O2要过量的原因是:________________。
(2)若该有机物只含C、H两种元素,且不含任何官能团,也不含脂环,则该有机物的分子式为________,它可能属于________(填序号)。
A.烷烃 B.苯的同系物 C.芳香烃 D.烃的衍生物
该物质可能的结构简式为_____________________。
(3)若该有机物分子中含有一个氧原子,则它可能是哪几类物质?请各举一例,填写在下表中:
物质种类 | 实例(写结构简式) |
_________ | _________ |
_________ | _________ |
_________ | _________ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化氢(H2O2)是重要的化工产品,广泛应用于绿色化学合成.医疗消毒等领域。
回答下列问题:
(1)已知:H2(g)+![]() O2(g)=H2O(l) △H1=-286 kJ·mol1
O2(g)=H2O(l) △H1=-286 kJ·mol1
H2(g)+O2(g)=H2O2(l) △H2=-188 kJ·mol1
过氧化氢分解反应2H2O2(l)=2H2O(l)+O2(g)的△H=______kJ·mol1。不同温度下过氧化氢分解反应的平衡常数K(313K)_____K(298K) (填大于、小于或等于)。
(2)100℃时,在不同金属离子存在下,纯过氧化氢24 h的分解率见下表:
离子 | 加入量(mg·L1) | 分解率% | 离子 | 加入量(mg·L1) | 分解率% |
无 | 0 | 2 | Fe3+ | 1.0 | 15 |
Al3+ | 10 | 2 | Cu2+ | 0.1 | 86 |
Zn2+ | 10 | 10 | Cr3+ | 0.1 | 96 |
由上表数据可知,能使过氧化氢分解反应活化能降低最多的离子是_______。贮运过氧化氢时,可选用的容器材质为_________(填标号)。
A.不锈钢 B.纯铝 C.黄铜 D.铸铁
(3)过氧化氢的Ka1=2.24×1012,H2O2的酸性________H2O (填大于、小于或等于)。
研究表明,过氧化氢溶液中HO2-的浓度越大,过氧化氢的分解速率越快。常温下,不同浓度的过氧化氢分解率与pH的关系如图所示。一定浓度的过氧化氢,pH增大分解率增大的原因是___________________:相同pH下,过氧化氢浓度越大分解率越低的原因是__________________________________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. SO2可以用来漂白纸浆、毛、丝、草帽辫,增白食品等
B. 糖类、油脂和蛋白质在一定条件下都能水解
C. 汽车尾气中含有的氮氧化物,是汽油不完全燃烧造成的
D. 高锰酸钾溶液、次氯酸钠溶液、双氧水都能杀菌消毒,这是利用他们的强氧化性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】t ℃时,在体积不变的密闭容器中发生反应:X(g)+3Y(g)![]() 2Z(g),各组分在不同时刻的浓度如下表:
2Z(g),各组分在不同时刻的浓度如下表:
物质 | X | Y | Z |
初始浓度/(mol·L-1) | 0.1 | 0.2 | 0 |
2 min末浓度/(mol·L-1) | 0.08 | a | b |
平衡浓度/(mol·L-1) | 0.05 | 0.05 | 0.1 |
下列说法正确的是( )
A. 平衡时,X的转化率为20%
B. 2 min时Y的物质的量为0.14
C. 增大平衡后的体系压强,v(正)增大,v(逆)减小
D. 2 min内,用Y的变化量表示的平均反应速率v(Y)=0.03 mol·L―1·min―1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com