
【题目】过氧化氢(H2O2)是重要的化工产品,广泛应用于绿色化学合成.医疗消毒等领域。
回答下列问题:
(1)已知:H2(g)+![]() O2(g)=H2O(l) △H1=-286 kJ·mol1
O2(g)=H2O(l) △H1=-286 kJ·mol1
H2(g)+O2(g)=H2O2(l) △H2=-188 kJ·mol1
过氧化氢分解反应2H2O2(l)=2H2O(l)+O2(g)的△H=______kJ·mol1。不同温度下过氧化氢分解反应的平衡常数K(313K)_____K(298K) (填大于、小于或等于)。
(2)100℃时,在不同金属离子存在下,纯过氧化氢24 h的分解率见下表:
离子 | 加入量(mg·L1) | 分解率% | 离子 | 加入量(mg·L1) | 分解率% |
无 | 0 | 2 | Fe3+ | 1.0 | 15 |
Al3+ | 10 | 2 | Cu2+ | 0.1 | 86 |
Zn2+ | 10 | 10 | Cr3+ | 0.1 | 96 |
由上表数据可知,能使过氧化氢分解反应活化能降低最多的离子是_______。贮运过氧化氢时,可选用的容器材质为_________(填标号)。
A.不锈钢 B.纯铝 C.黄铜 D.铸铁
(3)过氧化氢的Ka1=2.24×1012,H2O2的酸性________H2O (填大于、小于或等于)。
研究表明,过氧化氢溶液中HO2-的浓度越大,过氧化氢的分解速率越快。常温下,不同浓度的过氧化氢分解率与pH的关系如图所示。一定浓度的过氧化氢,pH增大分解率增大的原因是___________________:相同pH下,过氧化氢浓度越大分解率越低的原因是__________________________________________。

【答案】-196 小于 Cr3+ B 大于 pH升高,c(![]() )增大,分解速率加快 H2O2浓度越大,其电离度越小,分解率越小
)增大,分解速率加快 H2O2浓度越大,其电离度越小,分解率越小
【解析】
(1)根据盖斯定律计算反应热;根据放热反应,升温后平衡移动方向判断平衡常数的大小。
(2)由表中数据可知,加入铬离子,加入量最小,分解率最大;过氧化氢具有氧化性,可以氧化其他金属,但铝表面可以生成致密的氧化铝薄膜,阻止内部的铝继续腐蚀。
(3)通过比较电离常数大小比较酸性强弱;分析浓度和酸度对过氧化氢的电离平衡的影响。
(1)已知:① H2(g)+![]() O2(g)=H2O(l) △H1=-286 kJ·mol1
O2(g)=H2O(l) △H1=-286 kJ·mol1
②H2(g)+O2(g)=H2O2(l) △H2=-188 kJ·mol1
根据盖斯定律,①×2-②×2得:2H2O2(l)=2H2O(l)+O2(g)的△H=2△H1-2△H2=-196kJ·mol1。
该反应为放热反应,温度升高,化学平衡常数减小,所以K(313K)<K(298K) 。
故答案为:-196 ;小于。
(2)由表中数据可知,加入铬离子,加入量最小,分解率最大,所以能使过氧化氢分解反应活化能降低最多的离子是铬离子;过氧化氢具有氧化性,可以氧化其他金属,但铝表面可以生成致密的氧化铝薄膜,阻止内部的铝继续腐蚀,因此长时间可以选纯铝容器来贮运过氧化氢,故选B。
故答案为:Cr3+ ;B。
(3)Ka1>Kw,故H2O2电离出氢离子浓度大于水电离出的氢离子浓度,故H2O2的酸性>H2O;
pH增大,氢离子浓度减小,反应正向进行,HO2-的浓度增加,分解速率加快;
过氧化氢浓度越高,其电离程度越低,故分解率越小。
故答案为:大于;pH升高,c(![]() )增大,分解速率加快;H2O2浓度越大,其电离度越小,分解率越小。
)增大,分解速率加快;H2O2浓度越大,其电离度越小,分解率越小。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】无机非金属材料在信息科学、航空航天、建筑及能源等领域中得到广泛应用。下列无机非金属材料不属于含硅材料的是( )
A.水泥B.钢化玻璃C.光导纤维D.石墨烯(单层或少层石墨)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图(1)和图(2)是A、B两种物质的核磁共振氢谱。已知A、B两种物质都是烃类,都含有6个氢原子。请根据图(1)和图(2)两种物质的核磁共振氢谱图选择出可能属于图(1)和图(2)的两种物质( )
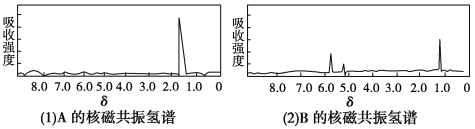
A. A是C3H6;B是C6H6
B. A是C2H6;B是C3H6
C. A是C2H6;B是C6H6
D. A是C3H6;B是C2H6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用核磁共振技术测定有机物分子的三维结构的研究曾获得诺贝尔化学奖。在有机物分子中,不同位置的氢原子的核磁共振氢谱中给出的峰值(信号)也不同。根据峰值(信号)可以确定有机物分子中氢原子的种类和数目。
例如:乙醚的结构式为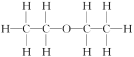 ,其核磁共振氢谱中有2个峰(信号)(参见下图)。
,其核磁共振氢谱中有2个峰(信号)(参见下图)。
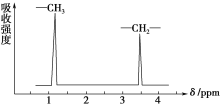
CH3CH2OCH2CH3的核磁共振氢谱
(1)下列分子中,其核磁共振氢谱中只有一种峰(信号)的物质是________。
A.CH3CH3 B.CH3COOH C.CH3COOCH3 D.CH3COCH3
(2)化合物A和B的分子式都是C2H4Br,A的核磁共振氢谱如图所示,则A的结构简式为________,请预测B的核磁共振氢谱上有________个峰(信号)。
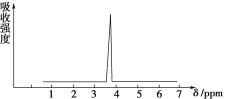
A的核磁共振氢谱示意图
(3)用核磁共振氢谱的方法来研究C2H6O的结构,请简要说明根据核磁共振氢谱的结果来确定C2H6O分子结构的方法是_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下,在3支相同容积的试管中分别充有等体积混合的两种气体,它们依次是:①NO2和CO,②NO2和O2,③NH3和N2。现将3支试管均倒置于水槽中,充分反应后,(假设试管内溶质不扩散)试管中所得溶液的物质的量浓度之比是( )
A. 1:1:1B. 5:4:5C. 3:2:3D. 2:3:3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是实验室制取乙烯的发生装置和验证乙烯性质的实验装置,反应原理为 CH3CH2OH![]() CH2=CH2↑+H2O。
CH2=CH2↑+H2O。
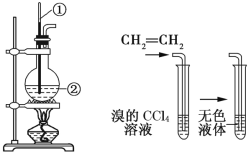
图1 图2
回答下列问题:
(1)图1中仪器①、②的名称分别为_______、_______。
(2)收集乙烯气体最好的方法是__________________。
(3)向溴的CCl4溶液中通入乙烯(如图2),溶液的颜色很快褪去,该反应属于_______(填反应类型),发生反应的化学方程式为_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20ml,0.1mol·L-1CH3COOH溶液中滴加0.1mol·L-1的NaOH溶液,其pH变化曲线如图所示(忽视温度变化)。下列说法中错误的是

A. c点表示CH3COOH和NaOH恰好反应完全
B. a点表示的溶液中由水电离出的H+浓度为1.0×10-11mol·L-1
C. b点表示的溶液中c(CH3COO-)>c(Na+)
D. b、d点表示的溶液中[c(CH3COO-)c(H+)]/c(CH3COOH)相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H是一种性能优异的高分子材料,其结构简式为:
![]()
已被广泛应用于声、热、光的传感等方面。它是由CH≡CH、(CN)2、CH3COOCHCH=CH2三种单体通过适当反应形成的。由H的结构简式分析合成过程中发生反应的类型是:①加成反应;②取代反应;③缩聚反应; ④加聚反应 ( )
A. ①② B. ①③ C. ①④ D. ①②④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com