
【题目】无机非金属材料在信息科学、航空航天、建筑及能源等领域中得到广泛应用。下列无机非金属材料不属于含硅材料的是( )
A.水泥B.钢化玻璃C.光导纤维D.石墨烯(单层或少层石墨)
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】某化学兴趣小组要完成中和热的测定。
(1)实验桌上备有大、小两个烧杯、泡沫塑料、泡沫塑料板、胶头滴管、环形玻璃搅拌棒、0.5 mol·L-1盐酸、0.55 mol·L-1 NaOH溶液,实验尚缺少的玻璃用品是___________、___________。
(2)实验中能否用环形铜丝搅拌棒代替环形玻璃搅拌棒___________(填“能”或“否”),其
原因是 。
(3)他们记录的实验数据如下:

已知:Q=cm(t2-t1),反应后溶液的比热容c为4.18 kJ·℃-1·kg-1,各物质的密度均为1 g·cm-3。
①计算完成上表ΔH=_____________。
②根据实验结果写出NaOH溶液与HCl溶液反应的热化学方程式: 。
(4)若用KOH代替NaOH,对测定结果__________(填“有”或“无”)影响;若用醋酸代替HCl做实验,对测定结果____________(填“有”或“无”)影响。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na2O2可用作漂白剂和呼吸面具中的供氧剂。
(1)某学习小组发现:在盛有Na2O2的试管中加入足量水,立即产生大量气泡,当气泡消失后,向其中滴入1~2滴酚酞试液,溶液变红;将试管轻轻振荡,红色很快褪去;此时再向试管中加入少量MnO2粉末,又有气泡产生。
①使酚酞试液变红是因为____________________________________,红色褪去的可能原因是____________________________________________。
②加入MnO2反应的化学方程式为_______________________________。
(2)Na2O2有强氧化性,H2具有还原性,有同学猜想Na2O2与H2能反应。为了验证此猜想,该小组同学进行如下实验,实验步骤和现象如下。
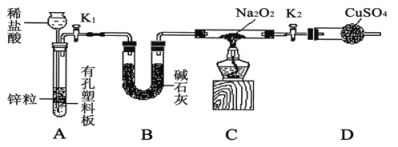
步骤1:按如图组装仪器(图中夹持仪器省略),检查气密性,装入药品;
步骤2:打开K1、K2,产生的氢气流经装有Na2O2的硬质玻璃管,一段时间后,没有任何现象;
步骤3:检验H2的纯度后,开始加热,观察到硬质玻璃管内Na2O2开始熔化,淡黄色的粉末变成了白色固体,干燥管内硫酸铜未变蓝色;
步骤4:反应后撤去酒精灯,待硬质玻璃管冷却后关闭K1。
①盛装稀盐酸的仪器名称___________;B装置的作用是______________。
②必须检验氢气纯度的原因是_________________。
③设置装置D的目的是___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】非金属单质A经如图所示的过程转化为含氧酸D,已知D为强酸,请回答下列问题:
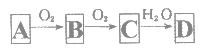
(1)若A在常温下为固体,B是能使品红溶液褪色的有刺激性气味的无色气体。
①D的化学式是_____;
②在工业生产中,B气体的大量排放被雨水吸收后会形成酸雨而污染环境。写出形成酸雨的化学方程式______。工业上常向煤中加入石灰石,减少B气体对环境的污染,其反应的化学方程式为_____。
(2)若A在常温下为气体,C是红棕色的气体。
①A转化为B的化学方程式是____。
②D的稀溶液在常温下可与铜反应并生成B气体,请写出该反应的离子方程式_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是( )
A. 不溶于水的银盐见光都能分解
B. AgBr见光分解,可制作感光材料
C. AgI可用于人工降雨
D. AgCl、AgBr和AgI既不溶于水也不溶于酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】洋蓟素是一种新结构类型的抗乙型肝炎病毒和抗艾滋病病毒的化合物,其结构如图所示,有关洋蓟素的说法正确的是( )
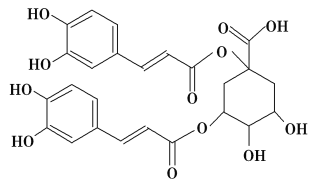
A. 1 mol洋蓟素最多可与6 mol Br2反应
B. 1 mol洋蓟素含6 mol酚羟基
C. 一定条件下能发生酯化反应和消去反应
D. 1 mol洋蓟素最多可与9 mol NaOH反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学-有机化学基础]
已知:![]()
为合成某种液晶材料的中间体M,有人提出如下不同的合成途径
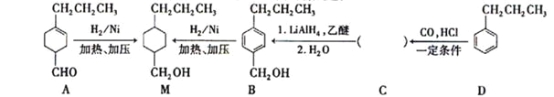
(1)常温下,下列物质能与A发生反应的有_______(填序号)
a.苯 b.Br2/CCl4 c.乙酸乙酯 d.KMnO4/H+溶液
(2)M中官能团的名称是____,由C→B反应类型为________。
(3)由A催化加氢生成M的过程中,可能有中间生成物![]() 和______(写结构简式)生成
和______(写结构简式)生成
(4)检验B中是否含有C可选用的试剂是_____(任写一种名称)。
(5)物质B也可由C10H13Cl与NaOH水溶液共热生成,C10H13Cl的结构简式为______。
(6)C的一种同分异构体E具有如下特点:
a.分子中含—OCH3CH3b.苯环上只有两种化学环境不同的氢原子
写出E在一定条件下发生加聚反应的化学方程式__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“共享单车”,低碳环保,有益健身,方便出行。“最后一公里”,下列关于单车的制造材料说法正确的是( )
A.制造车轮钢圈的材料是合金B.铝合金制造的车架较钢制造的重
C.制造轮胎用的橡胶有固定的熔点D.制作反光板的有机玻璃属于硅酸盐
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化氢(H2O2)是重要的化工产品,广泛应用于绿色化学合成.医疗消毒等领域。
回答下列问题:
(1)已知:H2(g)+![]() O2(g)=H2O(l) △H1=-286 kJ·mol1
O2(g)=H2O(l) △H1=-286 kJ·mol1
H2(g)+O2(g)=H2O2(l) △H2=-188 kJ·mol1
过氧化氢分解反应2H2O2(l)=2H2O(l)+O2(g)的△H=______kJ·mol1。不同温度下过氧化氢分解反应的平衡常数K(313K)_____K(298K) (填大于、小于或等于)。
(2)100℃时,在不同金属离子存在下,纯过氧化氢24 h的分解率见下表:
离子 | 加入量(mg·L1) | 分解率% | 离子 | 加入量(mg·L1) | 分解率% |
无 | 0 | 2 | Fe3+ | 1.0 | 15 |
Al3+ | 10 | 2 | Cu2+ | 0.1 | 86 |
Zn2+ | 10 | 10 | Cr3+ | 0.1 | 96 |
由上表数据可知,能使过氧化氢分解反应活化能降低最多的离子是_______。贮运过氧化氢时,可选用的容器材质为_________(填标号)。
A.不锈钢 B.纯铝 C.黄铜 D.铸铁
(3)过氧化氢的Ka1=2.24×1012,H2O2的酸性________H2O (填大于、小于或等于)。
研究表明,过氧化氢溶液中HO2-的浓度越大,过氧化氢的分解速率越快。常温下,不同浓度的过氧化氢分解率与pH的关系如图所示。一定浓度的过氧化氢,pH增大分解率增大的原因是___________________:相同pH下,过氧化氢浓度越大分解率越低的原因是__________________________________________。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com