
ЁОЬтФПЁПГЃЮТЯТЃЌЯђ20mlЃЌ0.1molЁЄL-1CH3COOHШмвКжаЕЮМг0.1molЁЄL-1ЕФNaOHШмвКЃЌЦфpHБфЛЏЧњЯпШчЭМЫљЪО(КіЪгЮТЖШБфЛЏ)ЁЃЯТСаЫЕЗЈжаДэЮѓЕФЪЧ

A. cЕуБэЪОCH3COOHКЭNaOHЧЁКУЗДгІЭъШЋ
B. aЕуБэЪОЕФШмвКжагЩЫЎЕчРыГіЕФHЃЋХЈЖШЮЊ1.0ЁС10Ѓ11molЁЄLЃ1
C. bЕуБэЪОЕФШмвКжаc(CH3COOЃ)>c(NaЃЋ)
D. bЁЂdЕуБэЪОЕФШмвКжа[c(CH3COO-)c(H+)]/c(CH3COOH)ЯрЕШ
ЁОД№АИЁПA
ЁОНтЮіЁП
A.гЩжаКЭЗДгІCH3COOH+NaOH=CH3COONa+H2OПЩжЊЃЌCH3COOHКЭNaOHЧЁКУЗДгІЭъШЋЪБШмвКЮЊCH3COONaШмвКЃЌЖјИУЧПМюШѕЫсбЮШмвКжаДцдкЫЎНтЦНКтCH3COO-+H2O![]() CH3COOH+OH-ЃЌШмвКЯдМюадЃЌЖјcЕуШмвКЯджаадЃЌЫљвдcЕуВЛФмБэЪОCH3COOHКЭNaOHЧЁКУЗДгІЭъШЋЃЌAЯюДэЮѓЃЛ
CH3COOH+OH-ЃЌШмвКЯдМюадЃЌЖјcЕуШмвКЯджаадЃЌЫљвдcЕуВЛФмБэЪОCH3COOHКЭNaOHЧЁКУЗДгІЭъШЋЃЌAЯюДэЮѓЃЛ
B.aЕуБэЪОЕЮЖЈЧАЕФДзЫсШмвКЃЌИљОнpH=3жЊШмвКжаH+ХЈЖШЮЊ10-3mol/LЃЌдђШмвКжаOH-ХЈЖШ=![]() mol/LЃЌДзЫсШмвКжаДцдкЫЎЕФЕчРыH2O
mol/LЃЌДзЫсШмвКжаДцдкЫЎЕФЕчРыH2O![]() H++OH-ЃЌИУЕчРыЦНКтЪмЕНДзЫсЕФвжжЦзїгУЃЌИУШмвКжаЕФOH-ШЋВПгЩЫЎЕчРыВњЩњЃЌЫљвдЫЎЕчРыГіЕФH+ХЈЖШ=ЫЎЕчРыГіЕФOH-ШмвК=10-11mol/LЃЌBЯюе§ШЗЃЛ
H++OH-ЃЌИУЕчРыЦНКтЪмЕНДзЫсЕФвжжЦзїгУЃЌИУШмвКжаЕФOH-ШЋВПгЩЫЎЕчРыВњЩњЃЌЫљвдЫЎЕчРыГіЕФH+ХЈЖШ=ЫЎЕчРыГіЕФOH-ШмвК=10-11mol/LЃЌBЯюе§ШЗЃЛ
C.гЩЭМЯёПЩжЊbЕуШмвКжаГЌЙ§вЛАыЕФДзЫсБЛжаКЭЃЌШмжЪЪЧCH3COONaКЭCH3COOHЕФЛьКЯШмвКЃЌШмвКЯдЫсадМДc(H+)>c(OH-)ЃЌИљОнЕчКЩЪиКугаЃКc(CH3COO-)+c(OH-)=c(Na+)+c(H+)ЃЌвђДЫc(CH3COO-)>c(Na+)ЃЌCЯюе§ШЗЃЛ
D.дкЕЮЖЈЙ§ГЬжаЃЈАќРЈbЁЂdСНЕуЃЉЖМгаДзЫсЕФЕчРыЦНКтЕФвЦЖЏЃКCH3COOH![]() CH3COO-+H+ЃЌЦфЕчРыЦНКтГЃЪ§ЮЊ
CH3COO-+H+ЃЌЦфЕчРыЦНКтГЃЪ§ЮЊ![]() ЃЌЖјKжЛгыЮТЖШгаЙиЃЌгыДзЫсЕФХЈЖШЮоЙиЃЌЫљвдbЁЂdЕуБэЪОЕФШмвКжа
ЃЌЖјKжЛгыЮТЖШгаЙиЃЌгыДзЫсЕФХЈЖШЮоЙиЃЌЫљвдbЁЂdЕуБэЪОЕФШмвКжа![]() жЕЯрЕШЃЌDЯюе§ШЗЃЛД№АИбЁAЁЃ
жЕЯрЕШЃЌDЯюе§ШЗЃЛД№АИбЁAЁЃ



| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЁАЙВЯэЕЅГЕЁБЃЌЕЭЬМЛЗБЃЃЌгавцНЁЩэЃЌЗНБуГіааЁЃЁАзюКѓвЛЙЋРяЁБЃЌЯТСаЙигкЕЅГЕЕФжЦдьВФСЯЫЕЗЈе§ШЗЕФЪЧ( )
A.жЦдьГЕТжИжШІЕФВФСЯЪЧКЯН№B.ТСКЯН№жЦдьЕФГЕМмНЯИжжЦдьЕФжи
C.жЦдьТжЬЅгУЕФЯ№НКгаЙЬЖЈЕФШлЕуD.жЦзїЗДЙтАхЕФгаЛњВЃСЇЪєгкЙшЫсбЮ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЙ§бѕЛЏЧт(H2O2)ЪЧживЊЕФЛЏЙЄВњЦЗЃЌЙуЗКгІгУгкТЬЩЋЛЏбЇКЯГЩЃЎвНСЦЯћЖОЕШСьгђЁЃ
ЛиД№ЯТСаЮЪЬтЃК
ЃЈ1ЃЉвбжЊЃКH2(g)ЃЋ![]() O2(g)ЃНH2O(l) ЁїH1ЃНЃ286 kJЁЄmol1
O2(g)ЃНH2O(l) ЁїH1ЃНЃ286 kJЁЄmol1
H2(g)ЃЋO2(g)ЃНH2O2(l) ЁїH2ЃНЃ188 kJЁЄmol1
Й§бѕЛЏЧтЗжНтЗДгІ2H2O2(l)ЃН2H2O(l)ЃЋO2(g)ЕФЁїHЃН______kJЁЄmol1ЁЃВЛЭЌЮТЖШЯТЙ§бѕЛЏЧтЗжНтЗДгІЕФЦНКтГЃЪ§K(313K)_____K(298K) (ЬюДѓгкЁЂаЁгкЛђЕШгк)ЁЃ
ЃЈ2ЃЉ100ЁцЪБЃЌдкВЛЭЌН№ЪєРызгДцдкЯТЃЌДПЙ§бѕЛЏЧт24 hЕФЗжНтТЪМћЯТБэЃК
Рызг | МгШыСП(mgЁЄL1) | ЗжНтТЪ% | Рызг | МгШыСП(mgЁЄL1) | ЗжНтТЪЃЅ |
Юо | 0 | 2 | Fe3ЃЋ | 1.0 | 15 |
Al3ЃЋ | 10 | 2 | Cu2ЃЋ | 0.1 | 86 |
Zn2ЃЋ | 10 | 10 | Cr3ЃЋ | 0.1 | 96 |
гЩЩЯБэЪ§ОнПЩжЊЃЌФмЪЙЙ§бѕЛЏЧтЗжНтЗДгІЛюЛЏФмНЕЕЭзюЖрЕФРызгЪЧ_______ЁЃжќдЫЙ§бѕЛЏЧтЪБЃЌПЩбЁгУЕФШнЦїВФжЪЮЊ_________(ЬюБъКХ)ЁЃ
AЃЎВЛатИж BЃЎДПТС CЃЎЛЦЭ DЃЎж§Ьњ
ЃЈ3ЃЉЙ§бѕЛЏЧтЕФKa1ЃН2.24ЁС1012ЃЌH2O2ЕФЫсад________H2O (ЬюДѓгкЁЂаЁгкЛђЕШгк)ЁЃ
баОПБэУїЃЌЙ§бѕЛЏЧтШмвКжаHO2-ЕФХЈЖШдНДѓЃЌЙ§бѕЛЏЧтЕФЗжНтЫйТЪдНПьЁЃГЃЮТЯТЃЌВЛЭЌХЈЖШЕФЙ§бѕЛЏЧтЗжНтТЪгыpHЕФЙиЯЕШчЭМЫљЪОЁЃвЛЖЈХЈЖШЕФЙ§бѕЛЏЧтЃЌpHдіДѓЗжНтТЪдіДѓЕФдвђЪЧ___________________ЃКЯрЭЌpHЯТЃЌЙ§бѕЛЏЧтХЈЖШдНДѓЗжНтТЪдНЕЭЕФдвђЪЧ__________________________________________ЁЃ

ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСаЫЕЗЈе§ШЗЕФЪЧ
A. SO2ПЩвдгУРДЦЏАзжННЌЁЂУЋЁЂЫПЁЂВнУББшЃЌдіАзЪГЦЗЕШ
B. ЬЧРрЁЂгЭжЌКЭЕААзжЪдквЛЖЈЬѕМўЯТЖМФмЫЎНт
C. ЦћГЕЮВЦјжаКЌгаЕФЕЊбѕЛЏЮяЃЌЪЧЦћгЭВЛЭъШЋШМЩедьГЩЕФ
D. ИпУЬЫсМиШмвКЁЂДЮТШЫсФЦШмвКЁЂЫЋбѕЫЎЖМФмЩБОњЯћЖОЃЌетЪЧРћгУЫћУЧЕФЧПбѕЛЏад
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСаЪЕбщВйзїЖдгІЕФЪЕбщЯжЯѓМАНтЪЭЛђНсТлЖМе§ШЗЕФЪЧ(ЁЁЁЁ)
бЁЯю | ЪЕбщВйзї | ЪЕбщЯжЯѓ | НтЪЭЛђНсТл |
A | ЯђFe(NO3)2ШмвКжаЕЮШыСђЫсЫсЛЏЕФH2O2ШмвК | ШмвКБфЮЊЛЦЩЋ | бѕЛЏадЃКH2O2>Fe3ЃЋ |
B | Яђ5mL1mol/L NaOHШмвКжаЕЮМг5ЕЮ1mol/L MgCl2ШмвКЃЌШЛКѓдйЕЮМгзуСПЕФ1mol/L CuCl2ШмвК | ЯШВњЩњАзЩЋГСЕэЃЌШЛКѓВњЩњРЖЩЋГСЕэ | Ksp[Cu(OH)2] >Ksp[Mg(OH)2] |
C | НЋГфТњNO2ЕФУмБеВЃСЇЧђНўХндкШШЫЎжа | КьзиЩЋБфЩю | 2NO2(g) |
D | ЯђвЛЖЈСПЫсадKMnO4ШмвКжаМгШыввЖўДМЃЈHOCH2CH2OHЃЉ | ШмвКзЯЩЋЭЪШЅ | ввЖўДМБЛбѕЛЏЮЊввЖўЫс |
A. A B. B C. C D. D
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПХ№УОФрЪЧвЛжжЙЄвЕЗЯСЯЃЌжївЊГЩЗнЪЧMgOЃЈеМ40%ЃЌжЪСПЗжЪ§ЃЉЃЌЛЙгаCaOЁЂMnOЁЂFe2O3ЁЂFeOЁЂAl2O3ЁЂSiO2ЕШдгжЪЃЌвдДЫЮЊдСЯжЦШЁЕФСђЫсУОЃЌПЩгУгкгЁШОЁЂдьжНЁЂвНвЉЕШЙЄвЕЁЃДгХ№УОФржаЬсШЁMgSO47H2OЕФЙЄвеСїГЬШчЯТЃК
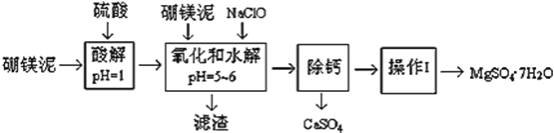
ЃЈ1ЃЉЪЕбщжаашвЊ1 mol/LЕФСђЫс800 mLЃЌШєгУ 98% ЕФХЈСђЫсЃЈІб= 1.84 g/mLЃЉРДХфжЦЃЌСПШЁХЈСђЫсашвЊЪЙгУСПЭВЕФЙцИёЮЊ__________ЃЈЬюаДбЁЯюзжФИЃЉ
AЃЎ10 mL BЃЎ20 mL CЃЎ50 mL DЃЎ100 mL
ЃЈ2ЃЉМгШыЕФNaClOПЩгыMn2+ ЗДгІЃКMn2+ + ClO + H2O = MnO2Ё§+ 2H+ + ClЃЌдкИУВНжшжаЛЙгавЛжжРызгвВЛсБЛNaClOбѕЛЏЃЌИУЗДгІЕФРызгЗНГЬЪНЮЊ___________________ЁЃ
ЃЈ3ЃЉТЫдќЕФжївЊГЩЗжГ§КЌгаFe(OH)3ЁЂAl(OH)3ЭтЃЌЛЙКЌга__________________ЁЃ
ЃЈ4ЃЉдкЁАГ§ИЦЁБЧАЃЌашМьбщТЫвКжаFe3+ ЪЧЗёБЛГ§ОЁЃЌМђЪіМьбщЗНЗЈ___________________ЁЃЃЈаДГіВйзїЁЂЯжЯѓКЭНсТлЃЉ
ЃЈ5ЃЉвбжЊMgSO4ЁЂCaSO4 ЕФШмНтЖШЃЈЕЅЮЛЮЊ g/100 g ЫЎЃЉШчЯТБэЃК
ЮТЖШЃЈЁцЃЉ | 40 | 50 | 60 | 70 |
MgSO4 | 30.9 | 33.4 | 35.6 | 36.9 |
CaSO4 | 0.210 | 0.207 | 0.201 | 0.193 |
ЁАГ§ИЦЁБЪЧНЋMgSO4КЭCaSO4ЛьКЯШмвКжаЕФCaSO4Г§ШЅЃЌИљОнЩЯБэЪ§ОнЃЌМђвЊЫЕУїВйзїВНжш_____________________________ЁЃЁАВйзїЂёЁБЪЧНЋТЫвКМЬајеєЗЂХЈЫѕЃЌРфШДНсОЇЃЌ______ЃЌБуЕУЕНСЫMgSO47H2O .
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПФГжжЗжЩЂЯЕЕФЗжЩЂжЪЕФСЃзгВЛФмЭИЙ§АыЭИФЄЃЌЕЋПЩвдЭИЙ§ТЫжНЃЌИУЗжЩЂЯЕЮЊЃЈ ЃЉ
A. ШмвК B. НКЬх C. аќзЧвК D. ШщзЧвК
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПt ЁцЪБЃЌдкЬхЛ§ВЛБфЕФУмБеШнЦїжаЗЂЩњЗДгІЃКX(g)ЃЋ3Y(g)![]() 2Z(g)ЃЌИїзщЗждкВЛЭЌЪБПЬЕФХЈЖШШчЯТБэЃК
2Z(g)ЃЌИїзщЗждкВЛЭЌЪБПЬЕФХЈЖШШчЯТБэЃК
ЮяжЪ | X | Y | Z |
ГѕЪМХЈЖШ/(molЁЄLЃ1) | 0.1 | 0.2 | 0 |
2 minФЉХЈЖШ/(molЁЄLЃ1) | 0.08 | a | b |
ЦНКтХЈЖШ/(molЁЄLЃ1) | 0.05 | 0.05 | 0.1 |
ЯТСаЫЕЗЈе§ШЗЕФЪЧ(ЁЁЁЁ)
A. ЦНКтЪБЃЌXЕФзЊЛЏТЪЮЊ20%
B. 2 minЪБYЕФЮяжЪЕФСПЮЊ0.14
C. діДѓЦНКтКѓЕФЬхЯЕбЙЧПЃЌv(е§)діДѓЃЌv(Фц)МѕаЁ
D. 2 minФкЃЌгУYЕФБфЛЏСПБэЪОЕФЦНОљЗДгІЫйТЪv(Y)ЃН0.03 molЁЄLЈD1ЁЄminЈD1
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯжгаЗДгІЃКmA (g) +nB (g)![]() pc (g) ЃЌДяЕНЦНКтКѓЃЌЕБЩ§ИпиЖШЪБЃЌBЕФзЊЛЏТЪБфДѓЃЛЕБМѕаЁбЙЧПЪБЃЌЛьКЯЬхЯЕжаCЕФжЪСПЗжЪ§вВМѕаЁЃЌдђЃК
pc (g) ЃЌДяЕНЦНКтКѓЃЌЕБЩ§ИпиЖШЪБЃЌBЕФзЊЛЏТЪБфДѓЃЛЕБМѕаЁбЙЧПЪБЃЌЛьКЯЬхЯЕжаCЕФжЪСПЗжЪ§вВМѕаЁЃЌдђЃК
ЃЈ1ЃЉИУЗДгІЕФФцЗДгІЮЊ____ШШЗДгІЃЌЧвm+n____p (ЬюЁА>ЁБЁЂ ЁА=ЁБ ЁЂЁА<ЁБЃЉЁЃ
ЃЈ2ЃЉМѕбЙЪБЃЌAЕФжЪСПЗжЪ§______.(ЬюЁАдіДѓЁБЁЂЁАМѕаЁЁБЛђЁАВЛБфЁБЃЌЯТЭЌЃЉ
ЃЈ3ЃЉШєМгШыB (ЬхЛ§ВЛБфЃЉЃЌдђAЕФзЊЛЏТЪ_____ЃЌBЕФзЊЛЏТЪ_________ЁЃ
ЃЈ4ЃЉШєЩ§ИпиЖШЃЌдђЦНКтЪБBЁЂCЕФХЈЖШжЎБШНЋ__________ЁЃ
ЃЈ5ЃЉШєМгШыДпЛЏМСЃЌЦНКтЪБЦјЬхЛьКЯЮяЕФзмЮяжЪЕФСП______________ЁЃ
ЃЈ6ЃЉШєBЪЧгаЩЋЮяжЪЃЌAЁЂCОљЮоЩЋЃЌдђМгШыC (ЬхЛ§ВЛБфЃЉЪБЛьКЯЮябеЩЋ______ЃЌЖјЮЌГжШнЦїФкбЙЧПВЛБфЃЌГфШыФЪЦјЪБЃЌЛьКЯЮябеЩЋ______(ЬюЁАБфЩюЁБЁЂ ЁАБфЧГЁБЛђЁАВЛБфЁБ)ЁЃ
ВщПДД№АИКЭНтЮі>>
ЙњМЪбЇаЃгХбЁ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com