
【题目】H是一种性能优异的高分子材料,其结构简式为:
![]()
已被广泛应用于声、热、光的传感等方面。它是由CH≡CH、(CN)2、CH3COOCHCH=CH2三种单体通过适当反应形成的。由H的结构简式分析合成过程中发生反应的类型是:①加成反应;②取代反应;③缩聚反应; ④加聚反应 ( )
A. ①② B. ①③ C. ①④ D. ①②④
科目:高中化学 来源: 题型:
【题目】过氧化氢(H2O2)是重要的化工产品,广泛应用于绿色化学合成.医疗消毒等领域。
回答下列问题:
(1)已知:H2(g)+![]() O2(g)=H2O(l) △H1=-286 kJ·mol1
O2(g)=H2O(l) △H1=-286 kJ·mol1
H2(g)+O2(g)=H2O2(l) △H2=-188 kJ·mol1
过氧化氢分解反应2H2O2(l)=2H2O(l)+O2(g)的△H=______kJ·mol1。不同温度下过氧化氢分解反应的平衡常数K(313K)_____K(298K) (填大于、小于或等于)。
(2)100℃时,在不同金属离子存在下,纯过氧化氢24 h的分解率见下表:
离子 | 加入量(mg·L1) | 分解率% | 离子 | 加入量(mg·L1) | 分解率% |
无 | 0 | 2 | Fe3+ | 1.0 | 15 |
Al3+ | 10 | 2 | Cu2+ | 0.1 | 86 |
Zn2+ | 10 | 10 | Cr3+ | 0.1 | 96 |
由上表数据可知,能使过氧化氢分解反应活化能降低最多的离子是_______。贮运过氧化氢时,可选用的容器材质为_________(填标号)。
A.不锈钢 B.纯铝 C.黄铜 D.铸铁
(3)过氧化氢的Ka1=2.24×1012,H2O2的酸性________H2O (填大于、小于或等于)。
研究表明,过氧化氢溶液中HO2-的浓度越大,过氧化氢的分解速率越快。常温下,不同浓度的过氧化氢分解率与pH的关系如图所示。一定浓度的过氧化氢,pH增大分解率增大的原因是___________________:相同pH下,过氧化氢浓度越大分解率越低的原因是__________________________________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】t ℃时,在体积不变的密闭容器中发生反应:X(g)+3Y(g)![]() 2Z(g),各组分在不同时刻的浓度如下表:
2Z(g),各组分在不同时刻的浓度如下表:
物质 | X | Y | Z |
初始浓度/(mol·L-1) | 0.1 | 0.2 | 0 |
2 min末浓度/(mol·L-1) | 0.08 | a | b |
平衡浓度/(mol·L-1) | 0.05 | 0.05 | 0.1 |
下列说法正确的是( )
A. 平衡时,X的转化率为20%
B. 2 min时Y的物质的量为0.14
C. 增大平衡后的体系压强,v(正)增大,v(逆)减小
D. 2 min内,用Y的变化量表示的平均反应速率v(Y)=0.03 mol·L―1·min―1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲烷和水蒸气反应的产物是合成甲醇的原料:CH4+H2O![]() CO+3H2
CO+3H2
已知:CO+2H2![]() CH3OH CO2+3H2
CH3OH CO2+3H2![]() CH3OH+H2O
CH3OH+H2O
300 mol CH4完全反应后的产物中,加入100 mol CO2后合成甲醇。若获得甲醇350 mol,残留氢气120 mol,计算CO和CO2的转化率。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从某含有FeCl2、FeCl3、CuCl2的工业废液中回收铜并制备氯化铁晶体的流程如下:则下列说法正确的是
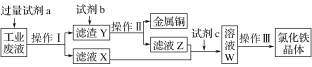
A. 试剂a是铁、试剂b是稀硫酸
B. 操作Ⅰ、操作Ⅱ、操作Ⅲ所用仪器相同
C. 试剂c是氯气,相应的反应为: 2Fe2++Cl2===2Cl-+2Fe3+
D. 用酸性KMnO4溶液可检验溶液W中是否还有Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质的性质与用途不对应的是( )
A. 铝合金的密度小,硬度大,可用作建筑材料
B. 食品工业中用Na2CO3作焙制糕点的膨松剂
C. FeCl3溶液能与Cu反应,可用于腐蚀铜制印刷电路板
D. 二氧化硅是制造光导纤维的材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有反应:mA (g) +nB (g)![]() pc (g) ,达到平衡后,当升高溫度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:
pc (g) ,达到平衡后,当升高溫度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:
(1)该反应的逆反应为____热反应,且m+n____p (填“>”、 “=” 、“<”)。
(2)减压时,A的质量分数______.(填“增大”、“减小”或“不变”,下同)
(3)若加入B (体积不变),则A的转化率_____,B的转化率_________。
(4)若升高溫度,则平衡时B、C的浓度之比将__________。
(5)若加入催化剂,平衡时气体混合物的总物质的量______________。
(6)若B是有色物质,A、C均无色,则加入C (体积不变)时混合物颜色______,而维持容器内压强不变,充入氖气时,混合物颜色______(填“变深”、 “变浅”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿矾是含有一定量结晶水的硫酸亚铁,在工农业生产中具有重要的用途。某班同学用如下实验探究其性质。回答下列问题:
(1)在试管中加入少量绿矾样品,加水溶解,配制成FeSO4溶液。在溶液中需加入少量铁屑,其目的是_____。
(2)甲组同学取2 mLFeSO4溶液,加入几滴氯水,再加入1滴KSCN溶液,溶液变红,说明Cl2可将Fe2+氧化。FeSO4溶液与氯水反应的离子方程式为______。
(3)乙组同学认为甲组的实验不够严谨,该组同学在2 mLFeSO4溶液中先加入0.5 mL 煤油,再于液面下依次加入几滴氯水和1滴KSCN溶液,溶液变红,煤油的作用是_________。
(4)丙组同学向盛有H2O2溶液的试管中加入几滴酸化的FeSO4溶液,溶液变成棕黄色,发生反应的离子方程式为________________
(5)为测定绿矾中结晶水含量,将石英玻璃管(带两端开关K1和K2)(设为装置A)称重,记为m1 g。将样品装入石英玻璃管中,再次将装置A称重,记为 m2 g。按下图连接好装置进行实验。
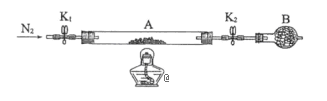
①仪器B的名称是______。
②将下列实验操作步骤正确排序_____(填标号);重复上述操作步骤,直至A恒重,记为m3 g。
a.点燃酒精灯,加热 b.熄灭酒精灯 c.关闭K1和K2
d.打开K1和K2,缓缓通入N2 e.称量A f.冷却到室温
③根据实验记录,计算绿矾化学式中结晶水数目x=_________(列式表示)。若实验时按a、d次序操作,则使x_______(填“偏大”“偏小”或“无影响”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com