
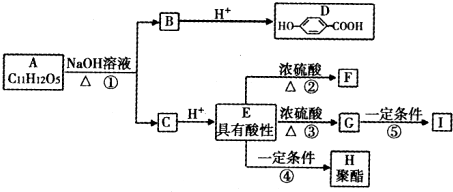
 .而C酸化得到E,E有酸性,则E中含有羧基,E在浓硫酸、加热条件下得到的F和G互为同分异构体,且F为五元环状化合物,G可使溴的四氯化碳溶液褪色,结合A的不饱和度为
.而C酸化得到E,E有酸性,则E中含有羧基,E在浓硫酸、加热条件下得到的F和G互为同分异构体,且F为五元环状化合物,G可使溴的四氯化碳溶液褪色,结合A的不饱和度为| 2×11+2-12 |
| 2 |
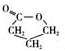 ,G的结构简式为CH2=CHCH2COOH,G在一定条件下发生加聚反应生成I为
,G的结构简式为CH2=CHCH2COOH,G在一定条件下发生加聚反应生成I为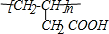 ,C的结构简式为:HOCH2CH2CH2COONa,则A的结构简式为
,C的结构简式为:HOCH2CH2CH2COONa,则A的结构简式为 ,E在一定条件下发生缩聚反应生成H为:
,E在一定条件下发生缩聚反应生成H为: ,据此解答.
,据此解答. .而C酸化得到E,E有酸性,则E中含有羧基,E在浓硫酸、加热条件下得到的F和G互为同分异构体,且F为五元环状化合物,G可使溴的四氯化碳溶液褪色,结合A的不饱和度为
.而C酸化得到E,E有酸性,则E中含有羧基,E在浓硫酸、加热条件下得到的F和G互为同分异构体,且F为五元环状化合物,G可使溴的四氯化碳溶液褪色,结合A的不饱和度为| 2×11+2-12 |
| 2 |
 ,G的结构简式为CH2=CHCH2COOH,G在一定条件下发生加聚反应生成I为
,G的结构简式为CH2=CHCH2COOH,G在一定条件下发生加聚反应生成I为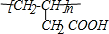 ,C的结构简式为:HOCH2CH2CH2COONa,则A的结构简式为
,C的结构简式为:HOCH2CH2CH2COONa,则A的结构简式为 ,E在一定条件下发生缩聚反应生成H为:
,E在一定条件下发生缩聚反应生成H为: ,
, ,
,| 催化剂 |
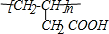 ,
, ;
;| 催化剂 |
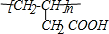 ;
;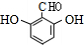 ,故答案为:
,故答案为: .
.


科目:高中化学 来源: 题型:
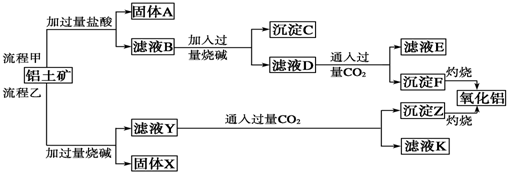
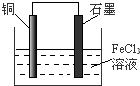
查看答案和解析>>
科目:高中化学 来源: 题型:
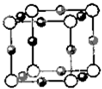 已知:A、B、C、D、E、F五种元素核电荷数依次增大,属周期表中前四周期的元素.其中A原子核外有三个未成对电子;化合物B2E的晶体为离子晶体,E原子核外的M层中只有两对成对电子;C元素是地壳中含量最高的金属元素;D单质的熔点在同周期元素形成的单质中是最高的;F原子核外最外层电子数与B相同,其余各层均充满.请根据以上信息,回答下列问题:
已知:A、B、C、D、E、F五种元素核电荷数依次增大,属周期表中前四周期的元素.其中A原子核外有三个未成对电子;化合物B2E的晶体为离子晶体,E原子核外的M层中只有两对成对电子;C元素是地壳中含量最高的金属元素;D单质的熔点在同周期元素形成的单质中是最高的;F原子核外最外层电子数与B相同,其余各层均充满.请根据以上信息,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Al(OH)3、CaCO3都难溶,但溶解的部分都能完全电离 |
| B、复盐是纯净物,而混盐(如CaOCl2)是混合物 |
| C、弱电解质溶液中有溶质分子,但强电解质溶液中难以存在溶质分子 |
| D、电解质溶液能够导电,是因为通电使电解质电离产生了自由移动的离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质 | 丙酮 | 乙酸乙酯 | 乙醇 | 乙酸 |
| 沸点(℃) | 56.2 | 77.06 | 78 | 117.9 |
查看答案和解析>>
科目:高中化学 来源: 题型:
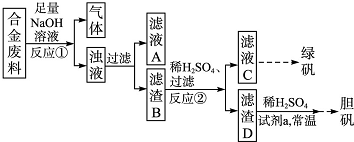
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na+、Ba2+、Cl-、SO42- |
| B、K+、Na+、NO3-、OH- |
| C、H+、NH4+、Fe3+、SO42- |
| D、H+、Cl-、CH3COO-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、两种溶液的pH不相同 |
| B、它们与NaOH完全中和时,醋酸溶液所消耗的NaOH多 |
| C、分别用水稀释相同倍数时,n(Cl-)=n(CH3COO-) |
| D、它们分别与足量CaCO3反应时,放出的CO2一样多 |
查看答案和解析>>
科目:高中化学 来源: 题型:
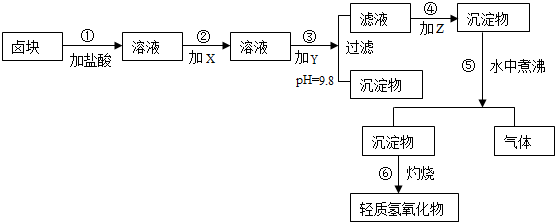
| 物质 | 开始沉淀 | 沉淀完全 | 试剂 | 价格(元/吨) | |
| Fe(OH)3 | 2.7 | 3.7 | 漂液(含NaClO25.2%) | 450 | |
| Fe(OH)2 | 7.6 | 9.6 | H2O2(30%) | 2400 | |
| Mn(OH)2 | 8.3 | 9.8 | NaOH(固98%) | 2100 | |
| Mg(OH)2 | 9.6 | 11.1 | Na2CO3(固95%) | 600 | |
| 卤块(MgCl2,30%) | 310 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com