
【题目】苯与液溴制取溴苯:

(1)装置A的名称是 _____________________________。
(2)制取溴苯的化学反应方程式 _____________________________。
(3)反应时,装置B中出现的现象有 _________________________。
(4)装置C中导管位置为什么不能伸入液面以下,请解释原因 _____________________。
(5)装置D的作用是 _____________________ 。
(6)反应结束后,将滴液漏斗中的溶液E加入到烧瓶B中,充分振荡后可除去溴苯中的溴,溶液E是 _______________。液体经过分液,所得的溴苯中还含有少量苯,如何进行分离?________(备选答案:过滤/萃取/蒸馏/重结晶)。
【答案】 直形冷凝管(写冷凝管即可) ![]() (催化剂写铁不扣分) 液体呈沸腾状,烧瓶中有红棕色蒸气 防止倒吸 吸收尾气,防止污染空气 氢氧化钠溶液 蒸馏
(催化剂写铁不扣分) 液体呈沸腾状,烧瓶中有红棕色蒸气 防止倒吸 吸收尾气,防止污染空气 氢氧化钠溶液 蒸馏
【解析】(1)根据装置图可知A的名称是直形冷凝管;(2)在铁作催化剂的作用下,苯和液溴反应生成溴苯,方程式为![]() 。(3)液溴易挥发,反应放热,所以反应时,装置B中出现的现象有液体呈沸腾状,烧瓶中有红棕色蒸气。(4)溴化氢极易溶于水,所以装置C中导管位置不能伸入液面以下,防止倒吸;(5)溴有毒,装置D中的作用是吸收尾气,防止污染空气。(6)溴单质能溶解在氢氧化钠溶液中,所以可加入氢氧化钠溶液。溴苯不溶于水,分液即可。溴苯和苯的沸点相差较大,可以通过蒸馏法实现二者的分离。
。(3)液溴易挥发,反应放热,所以反应时,装置B中出现的现象有液体呈沸腾状,烧瓶中有红棕色蒸气。(4)溴化氢极易溶于水,所以装置C中导管位置不能伸入液面以下,防止倒吸;(5)溴有毒,装置D中的作用是吸收尾气,防止污染空气。(6)溴单质能溶解在氢氧化钠溶液中,所以可加入氢氧化钠溶液。溴苯不溶于水,分液即可。溴苯和苯的沸点相差较大,可以通过蒸馏法实现二者的分离。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】判断下列说法正确的是
A. 向SO2水溶液中加入过量NaOH可得到Na2SO3、NaHSO3和NaOH的混合液
B. SO2具有氧化性,故可作漂白剂
C. 浓硫酸和浓盐酸长期暴露在空气中浓度都降低
D. 浓硫酸具有强氧化性,常温下能与Cu发生剧烈反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】文献报道:利用氯化氢氧化反应一脱水耦合工艺,可用有机氯化工艺的副产品氯化氢为原料制备氯气,实现氯的循环利用,原理为4HCl(g)+O2(g)![]() 2Cl2(g)+2H2O(g).将HC1和O2分别以5种物质的量比:①1:1 ②2:1 ③4:1 ④6:1 ⑤8:1,向五个容积可变的容器中投料时,反应温度对HCl平衡转化率影响的曲线如图.
2Cl2(g)+2H2O(g).将HC1和O2分别以5种物质的量比:①1:1 ②2:1 ③4:1 ④6:1 ⑤8:1,向五个容积可变的容器中投料时,反应温度对HCl平衡转化率影响的曲线如图.

请回答下列问题:
(1)可以判断该反应已经达到化学平衡的是__. (填字母).
A.密闭容器中总压强不变 B.密闭容器中混合气体的密度不变
C.v(HCl)=2v(Cl2) D.密闭容器中氯气的体积分数不变
(2)d曲线对应的投料比是__(填比值,从题干中选择,下同).有机工业需要含O2量低的氧气和氯化氢混合气体,可控制n(HCl):n(O2)=_______制备.
(3)该反应的平衡常数表达式为________.
(4)若按b曲线对应的投料比进行反应,且温度为415℃,反应达到平衡时Cl2的体积分数为_______.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
19-Ⅰ
下列叙述正确的有_______。
A.某元素原子核外电子总数是最外层电子数的5倍,则其最高正价为+7
B.钠元素的第一、第二电离能分别小于镁元素的第一、第二电离能
C.高氯酸的酸性与氧化性均大于次氯酸的酸性和氧化性
D.邻羟基苯甲醛的熔点低于对羟基苯甲醛的熔点
19-Ⅱ
ⅣA族元素及其化合物在材料等方面有重要用途。回答下列问题:
(1)碳的一种单质的结构如图(a)所示。该单质的晶体类型为___________,原子间存在的共价键类型有________,碳原子的杂化轨道类型为__________________。



(2)SiCl4分子的中心原子的价层电子对数为__________,分子的立体构型为________,属于________分子(填“极性”或“非极性”)。
(3)四卤化硅SiX4的沸点和二卤化铅PbX2的熔点如图(b)所示。
①SiX4的沸点依F、Cl、Br、I次序升高的原因是_________________。
②结合SiX4的沸点和PbX2的熔点的变化规律,可推断:依F、Cl、Br、I次序,PbX2中的化学键的离子性_______、共价性_________。(填“增强”“不变”或“减弱”)
(4)碳的另一种单质C60可以与钾形成低温超导化合物,晶体结构如图(c)所示。K位于立方体的棱上和立方体的内部,此化合物的化学式为_______________;其晶胞参数为1.4 nm,晶体密度为_______g·cm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列推断正确的是
A、N2、NO、NO2都是大气污染气体,在空气中都能稳定存在
B、向AlCl3溶液中滴加过量的氨水能看到先产生白色沉淀,后沉淀溶解
C、可用浓硫酸或者浓硝酸除去镀在铝表面的铜镀层
D、在稀硫酸中加入铜粉,铜粉不溶解;再加入Cu(NO3)2固体,铜粉就会溶解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于CH3—CH=CH—C≡C—CF3分子结构的叙述中,正确的是
A.6个碳原子有可能都在一条直线上B.6个碳原子可能都在一条直线上
C.6个碳原子一定都在同一平面上D.6个碳原子不可能都在同一平面上
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)用双线桥法表示下列反应中电子转移的方向和数目:Cl2+SO2+2H2O=2HCl+H2SO4_________________________。
在上述反应中,若反应消耗35.5 g Cl2,同时消耗标准状况下SO2的体积约为______L,转移电子的物质的量为________mol。
(2)实验室利用如图装置快速制备少量氯气,可利用以下反应:2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O。此反应不需要加热,常温下就可以迅速进行,而且对盐酸的浓度要求不高。

①写出该反应的离子方程式:_______________________________。
②该反应中,氧化产物是________。
③当电子转移的数目为6.02×1023时,生成的氯气在标准状况下的体积为________,被氧化的Cl-个数为________。
(3)实验室也可以利用如图装置制备氯气,反应方程式为:2MnO2+4HCl![]() MnCl2+Cl2↑+2H2O。
MnCl2+Cl2↑+2H2O。

在上述反应中,还原剂是_____,若有1 mol氧化剂参与反应,转移电子的物质的量为____mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)从樟科植物枝叶提取的精油中含有甲、乙两种成分:

①请写出甲的一种能同时满足下列3个条件的同分异构体的结构简式________。
a.苯环上有两个不同的取代基
b.能与Br2的CCl4溶液发生加成反应
c.遇FeCl3溶液显呈现紫色
②由甲转化为乙的过程为(已略去无关产物):

反应Ⅰ的反应类型为________,Y的结构简式__________。
(2)写出下图高聚物所对应的单体:
____________________,_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水煤气的主要成分是氢气和一氧化碳,由水蒸气和炽热的无烟煤或焦炭作用而得.是重要的化工原料,可用于合成甲醇和甲醚等有机化合物,已知:
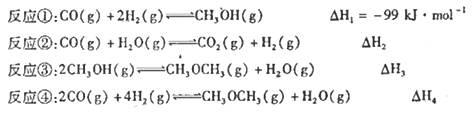
(1)△H1= ______(用△H2、△H3、△H4)。
(2)反应②的存在,可大大提高CH30CH3的产率,原因是: ________。
C0(g)和H2(g)以物质的量之比1:2混合,一定条件下在1L固定容积内发生反应①,下图表示温度分别为300℃、500℃的密闭容器中,甲醇的物质的量与时间的关系。回答下列问题:

①C、D两点平衡常数KC _____KD(填>、<、= )。
②在其他条件不变的情况下,对处于E点的体系体积压缩到原来的1/2下列有关该体系的说法正确的是 _______。
a. 正反应速率加快,逆反应速率也加快
b.甲醇的物质的量增加
c.重新平衡时n(H2)/n(CH3OH)增大
(4)温度为T时,向容积1L的密闭容器甲、乙中分别充入一定量的CO(g)和H20(g),发生反应②,相关数据如下:

①甲容器中,反应在t1min内的平均速率v(H2)= ____mol/(Lmin)。
②乙容器中,a=_____mol。
③解释降低温度使C02平衡浓度增大的原因___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com