
����Ŀ�����ױ����������Ȼ���������Ӧһ��ˮ��Ϲ��գ������л��Ȼ����յĸ���Ʒ�Ȼ���Ϊԭ���Ʊ�������ʵ���ȵ�ѭ�����ã�ԭ��Ϊ4HCl��g��+O2��g��![]() 2Cl2��g��+2H2O��g������HC1��O2�ֱ���5�����ʵ����ȣ���1��1 ��2��1 ��4��1 ��6��1 ��8��1��������ݻ��ɱ��������Ͷ��ʱ����Ӧ�¶ȶ�HClƽ��ת����Ӱ���������ͼ��
2Cl2��g��+2H2O��g������HC1��O2�ֱ���5�����ʵ����ȣ���1��1 ��2��1 ��4��1 ��6��1 ��8��1��������ݻ��ɱ��������Ͷ��ʱ����Ӧ�¶ȶ�HClƽ��ת����Ӱ���������ͼ��

��ش��������⣺
��1�������жϸ÷�Ӧ�Ѿ��ﵽ��ѧƽ�����__�� ������ĸ����
A���ܱ���������ѹǿ���� B���ܱ������л��������ܶȲ���
C��v��HCl��=2v��Cl2�� D���ܱ������������������������
��2��d���߶�Ӧ��Ͷ�ϱ���__�����ֵ���������ѡ����ͬ�����л���ҵ��Ҫ��O2���͵��������Ȼ��������壬�ɿ���n��HCl����n��O2��=_______�Ʊ���
��3���÷�Ӧ��ƽ�ⳣ������ʽΪ________��
��4������b���߶�Ӧ��Ͷ�ϱȽ��з�Ӧ�����¶�Ϊ415�棬��Ӧ�ﵽƽ��ʱCl2���������Ϊ_______��
���𰸡� AD 6:1 8:1 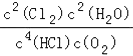 30.8%��
30.8%��
����������1��4HCl��g��+O2��g��2Cl2��g��+2H2O��g������Ӧ�����������С�ķ�Ӧ��
A���������ʵ��������仯�����ܱ���������ѹǿ���䣬˵����Ӧ�ﵽƽ��״̬����A��ȷ��B�������������䣬������䣬�ܱ������л��������ܶ�ʼ�ղ��䣬��B����C����Ӧ����֮�ȵ��ڻ�ѧ����ʽ������֮�ȣ�Ϊ����Ӧ����֮�ȣ�v��HCl��=2v��Cl2������˵�����淴Ӧ������ͬ������˵����Ӧ�ﵽƽ��״̬����C����D���ܱ������К������������������ƽ���־����D��ȷ����ѡAD��
��2����������������ʱ��O2����Խ��HCl��ת����Խ���ɴ˿�ȷ��aΪ1��1��bΪ2��1��cΪ4��1��dΪ6��1��eΪ8��1���л���ҵ��Ҫ��O2���͵��������Ȼ��������壬�ɿ���n��HCl����n��O2��=8��1����3���÷�Ӧ��ƽ�ⳣ������ʽΪ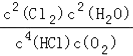 ����4����ͼ�ɶ���Ͷ�ϱ�Ϊ2��1���¶�Ϊ415��ʱ��HCl��ת����Ϊ80%����Ͷ���HClΪ2mol��O2Ϊ1mol���ɴ˿ɽ�������ʽ��
����4����ͼ�ɶ���Ͷ�ϱ�Ϊ2��1���¶�Ϊ415��ʱ��HCl��ת����Ϊ80%����Ͷ���HClΪ2mol��O2Ϊ1mol���ɴ˿ɽ�������ʽ��

����ƽ��������Cl2�����ʵ�������=![]() =30.8%��
=30.8%��


 ����ʦ��Сһ����ʦ������ҵϵ�д�
����ʦ��Сһ����ʦ������ҵϵ�д� ���100�ֵ�Ԫ�Ż�������ϵ�д�
���100�ֵ�Ԫ�Ż�������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����
A��������ķ�Ӧһ�����Է���Ӧ B��������ķ�Ӧһ�����Է���Ӧ
C���ء��ʶ�Ϊ��ֵ�ķ�Ӧ���Է���Ӧ D����HT��S<0�ķ�Ӧһ�����Է���Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���屽��һ�ֻ���ԭ�ϣ�ʵ���Һϳ��屽��װ��ʾ��ͼ���й��������£�

�� | �� | �屽 | |
�ܶ�/(g��cm��3) | 0.88 | 3.10 | 1.50 |
�е�/�� | 80 | 59 | 156 |
ˮ���ܽ�� | �� | �� | �� |
�����кϳɲ���ش����⣺
(1)��a�м���15 mL��ˮ����������м����b��С�ļ���4.0 mLҺ̬�塣��a�е��뼸���壬�а�ɫ��������������Ϊ������ ���塣�����μ���Һ����ꡣװ��d�������� ��
(2)Һ�����������в�������ᴿ��
����a�м���10 mLˮ��Ȼ����˳�ȥδ��Ӧ����м��
����Һ������10 mLˮ��8 mL 10%��NaOH��Һ��10 mLˮϴ�ӡ�NaOH��Һϴ�ӵ������� ��
����ֳ��Ĵ��屽�м�����������ˮ�Ȼ��ƣ����á����ˡ������Ȼ��Ƶ�Ŀ���� ��
(3)�����Ϸ���������屽�л����е���Ҫ����Ϊ ��Ҫ��һ���ᴿ�����в����б������ (������ȷѡ��ǰ����ĸ)��
A���ؽᾧ B������ C������ D����ȡ
(4)�ڸ�ʵ���У�a���ݻ����ʺϵ��� (������ȷѡ��ǰ����ĸ)��
A��25 mL B��50 mL C��250 mL D��500 mL
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���飨As���ǵ������ڢ�A��Ԫ�أ������γ�As2O3��As2O5��H3AsO3��H3AsO4�Ȼ�������Ź㷺����;���ش��������⣺
��1���������ԭ�ӽṹʾ��ͼ____________��
��2����ҵ�ϳ��������������Ҫ�ɷ�ΪAs2S3���Ƴɽ�״��ͨ��O2����������H3AsO4�͵�����д��������Ӧ�Ļ�ѧ����ʽ________���÷�Ӧ��Ҫ�ڼ�ѹ�½��У�ԭ����________��
��3����֪��As(s)+![]() H2(g)+2O2(g)=H3AsO4(s) ��H1
H2(g)+2O2(g)=H3AsO4(s) ��H1
H2(g)+![]() O2(g)=H2O(l) ��H2
O2(g)=H2O(l) ��H2
2As(s)+![]() O2(g) =As2O5(s) ��H3
O2(g) =As2O5(s) ��H3
��ӦAs2O5(s) +3H2O(l)= 2H3AsO4(s)�Ħ�H =_________��
��4��298 Kʱ����20 mL 3x mol��L1 Na3AsO3��20 mL 3x mol��L1 I2��20 mL NaOH��Һ��ϣ�������Ӧ��AsO33(aq)+I2(aq)+2OH![]() AsO43(aq)+2I(aq)+ H2O(l)����Һ��c(AsO43)�뷴Ӧʱ�䣨t���Ĺ�ϵ��ͼ��ʾ��
AsO43(aq)+2I(aq)+ H2O(l)����Һ��c(AsO43)�뷴Ӧʱ�䣨t���Ĺ�ϵ��ͼ��ʾ��

�����п��жϷ�Ӧ�ﵽƽ�����__________�����ţ���
a.��Һ��pH���ٱ仯
b.v(I)=2v(AsO33)
c. c (AsO43)/c (AsO33)���ٱ仯
d. c(I)=y mol��L1
��tmʱ��v��_____ v��������ڡ���С�ڡ����ڡ�����
��tmʱv��_____ tnʱv��������ڡ���С�ڡ����ڡ�����������_____________��
����ƽ��ʱ��Һ��pH=14����÷�Ӧ��ƽ�ⳣ��KΪ___________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ˮ(D2O)����Ҫ�ĺ˹�ҵԭ�ϣ�����˵���������
A. 1H��D����ͬλ�� B. 1H218Dͨ����ѧ�仯����ʵ��
C. H2O��D2O��Ħ��������ͬ D. 1H218O��D216O���������ʲ�ͬ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����λ���������������ɺͽṹ����ɫɫ���ḻ��ʡ���ָ�������[Cu(NH3)4](OH)2���������ӡ����塢�������ӵĵ��������λ����������
A.Cu2+��NH3��2+��2B.Cu+��NH3��1+��4
C.Cu2+��OH-��2+��2D.Cu2+��NH3��2+��4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ʵ����Ǹ��л�ѧ����ĺ��ģ�
��1����ͬ���ʵ�����NH3��H2S��������___�����Ӹ�����Ϊ___��ͬ��ͬѹ�µ������__��������ԭ�ӵĸ�����Ϊ____��
��2������m gij���壬����һ����������ԭ�ӹ��ɣ�����Ħ������ΪM g/mol���谢��٤������ΪNA����
�ٸ���������ʵ���Ϊ____mol��
�ڸ�������������ԭ������Ϊ____����
�۸������ڱ�״���µ����Ϊ___L��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Һ����ȡ�屽��

��1��װ��A�������� _____________________________��
��2����ȡ�屽�Ļ�ѧ��Ӧ����ʽ _____________________________��
��3����Ӧʱ��װ��B�г��ֵ������� _________________________��
��4��װ��C�е���λ��Ϊʲô��������Һ�����£������ԭ�� _____________________��
��5��װ��D�������� _____________________ ��
��6����Ӧ��������Һ©���е���ҺE���뵽��ƿB�У������ɳ�ȥ�屽�е��壬��ҺE�� _______________��Һ�徭����Һ�����õ��屽�л���������������ν��з��룿________����ѡ�𰸣�����/��ȡ/����/�ؽᾧ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ�У������ȷ�Ӧ��Ҳ��������ԭ��Ӧ���ǣ� ��
A. Ba(OH)2�q8H2O��NH4Cl������ B. ������NaOH��Һ���
C. ���ȵ�̼��ˮ������Ӧ D. ��������ʯ��ʯ
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com