
【题目】Na2S2O5可用作食品的抗氧化剂。为测定某葡萄酒中Na2S2O5残留量,取50.00 mL葡萄酒样品,用0.01000 mol·L1的碘的水溶液与其反应,恰好消耗10.00 mL。下列说法正确的是( )
A.反应的离子方程式为:S2O52- + I2 + 3H2O = 2SO42- + 2I-+ 6H+
B.该反应转移电子数为1×10-3NA
C.该样品中Na2S2O5的残留量,若以SO2计为0.128 g·L1
D.反应结束后,所得溶液的pH比原溶液增大
【答案】C
【解析】
A.Na2S2O5可用作食品的抗氧化剂,说明Na2S2O5具有一定的还原性,能被碘标准液滴定,说明发生氧化还原反应产生Na2SO4,I2被还原为I-,则发生滴定反应的离子方程式为:S2O52-+2I2+3H2O═2SO42-+4I-+6H+,故A错误;
B.10.00 mL 0.01000 mol·L1的碘的水溶液中I2的物质的量为0.01L× 0.01000 mol·L1=1× 10 -4mol,在S2O52-+2I2+3H2O═2SO42-+4I-+6H+中I元素从0价降为-1价,则该反应转移电子数为2×10-4NA,故B错误;
C.根据S2O52-+2I2+3H2O═2SO42-+4I-+6H+可知Na2S2O5的物质的量为0.5× 10 -4mol,若以SO2计应为![]() =0.128 g·L1,故C正确;
=0.128 g·L1,故C正确;
D.由S2O52-+2I2+3H2O═2SO42-+4I-+6H+可知,反应后所得溶液的pH比原溶液减小,故D错误;
故答案为B。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
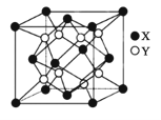
【题目】2019年的化学诺贝尔奖颁给了为锂电池研究作出贡献的三位科学家,其研究的是两种常见锂电池:一种是采用镍钴锰酸锂Li(NiCoMn)O2或镍钴铝酸锂为正极的“三元材料锂电池”;另一种是采用磷酸铁锂(LiFePO4)为正极的电池。请回答下列问题:
(1)利用FeSO4、(NH4)2HPO4、LiOH为原料以物质的量之比1∶1∶1反应生成LiFePO4,该化学反应方程式为________________。
(2)Mn位于元素周期表的_____区(填“s”或“p”或“d”或“ds”或“f”),基态钴原子的未成对电子数为______,1mol [CoCl (NH3)5] Cl2 中含σ键数目为__NA。
(3)磷元素可以形成多种含氧酸H3PO4、H3PO2、H3PO3、HPO3,这四种酸中酸性最强的是_____。PO43-的空间构型是___,中心原子的杂化方式是______。
(4)PH3是_____分子(填“极性”或“非极性”),其在水中的溶解性比NH3小,原因是______。
(5)硫化锂Li2S(摩尔质量Mgmol-1)的纳米晶体是开发先进锂电池的关键材料,硫化锂的晶体为反萤石结构,其晶胞结构如图。若硫化锂晶体的密度为ag·cm-3,则距离最近的两个S2-的距离是_______nm。(用含a、M、NA的计算式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是中学化学中常用于混合物的分离和提纯的装置,请根据装置回答问题:
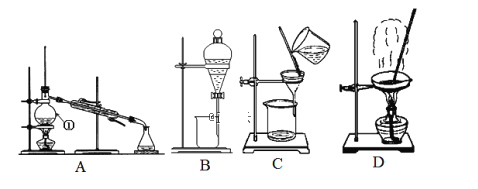
Ⅰ.(1)从碘水中分离出I2,选择装置_______,该分离方法的名称为_________。
(2)写出上图中仪器①的名称___________________ ;
(3)冷凝管中冷却水的方向为________________________ 。
Ⅱ.实验室要配制2mol/L稀硫酸240mL。
(1)量取18.4mol/L的浓硫酸时,用下面那种规格的量筒___(填序号)
①10mL ②50mL ③100mL ④500mL
(2)配制该稀硫酸时使用的仪器除量筒、烧杯外,还必须用到的仪器有玻璃棒、胶头滴管、________。
(3)在配制过程中,如果出现下列情况,将对所配溶液的物质的量浓度有何影响?(填“偏高”、“偏低”或“无影响”)
①用量筒量取浓硫酸时,仰视量筒进行读数________;
②定容时,液面超过刻度线后用胶头滴管吸至液面处______;
Ⅲ.200mL 5mol/L NaOH溶液中,取出20mL溶液,其溶质的质量是___________;将取出的溶液稀释至100mL,其溶质的物质的量浓度是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列分子或离子中,VSEPR(价层电子对互斥理论)模型名称与分子或离子的空间构型名称不一致的是
A.CO2B.CO32-C.H2OD.CC14
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图装置制取下表中的四种气体(图中夹持仪器已略去;a、b、c表示相应仪器中加入的试剂),能达到实验目的的是( )
选项 | 气体 | a | b | c |
|
A | H2 | 稀硫酸 | Zn | 浓硫酸 | |
B | CO2 | 盐酸 | CaCO3 | 饱和碳酸氢钠溶液 | |
C | NH3 | 浓氨水 | CaO | 浓硫酸 | |
D | Cl2 | 浓盐酸 | MnO2 | 饱和食盐水 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今有如下3个热化学方程式:H2(g)+![]() O2(g)= H2O(g) △H=a kJ/mol,H2(g)+
O2(g)= H2O(g) △H=a kJ/mol,H2(g)+ ![]() O2(g)= H2O(l) △H=b kJ/mol,2H2(g) +
O2(g)= H2O(l) △H=b kJ/mol,2H2(g) + ![]() O2(g)= 2H2O(l) △H=c kJ/mol,关于它们的下列表述正确的是:
O2(g)= 2H2O(l) △H=c kJ/mol,关于它们的下列表述正确的是:
A.它们都是吸热反应B.a、b、c均为正值C.a=bD.c=2b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用元素的化合价推测物质的性质是化学研究的重要手段,氮元素的常见化合价与部分物质类别的对应关系如图所示。
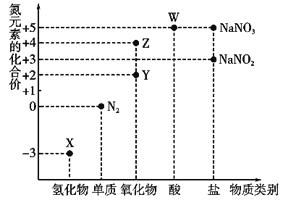
(1)从氮元素化合价的角度分析,X、Y、Z、W中既具有氧化性又具有还原性的有______(填化学式)。
(2) N2O是硝酸生产中氨催化氧化的副产物,用特种催化剂能使N2O分解。NH3与O2在加热和催化剂作用下生成N2O的化学方程式为_______________。尾气中的NO用酸性NaClO溶液吸收,其原理是HClO氧化NO生成Cl和NO3-,其离子方程式为______________________________________。
(3)将集满红棕色气体Z的试管倒置于盛有水的水槽中,观察到的现象为_______________________。
(4)W的稀溶液与铜单质发生反应的离子方程式为__________________________。
(5)已知NaNO2能被酸性KMnO4溶液氧化为NaNO3,则50mL0.01 mol·L-1 NaNO2溶液与10mL0.02 mol·L-1 KMnO4溶液恰好完全反应时,还原产物中Mn元素的化合价为__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关叙述正确的是( )

A. 如上图所示是测定中和热的简易装置,大小两烧杯间填满碎泡沫塑料的作用是固定小烧杯
B. 若用50 mL 0.55 mol·L-1的氢氧化钠溶液,分别与50 mL 0.50 mol·L-1的盐酸和50 mL0.50 mol·L-1的硫酸充分反应,两反应测定的中和热不相等
C. 实验时需要记录初始温度T1和最高温度T2
D. 做一次实验根据公式即可得出中和反应的反应热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】废定影液含Ag(S2O3)23-和Br-等,实验室从中回收Ag和Br2的主要步骤为:向废定影液中加入Na2S溶液沉淀银离子,过滤、洗涤、干燥,灼烧Ag2S制取金属Ag;制取Cl2并将Cl2通入滤液中氧化Br-,再用苯萃取分液。其中部分实验操作的装置如图所示,下列叙述正确的是( )
A.用装置甲分离Ag2S时,用玻璃棒不断搅拌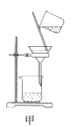
B.用装置乙在通风橱中高温灼烧Ag2S制取Ag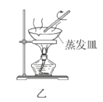
C.用装置丙制备Cl2 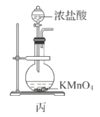
D.用装置丁分液时,先放出水层再换个烧杯继续放出有机层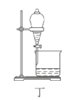
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com