
【题目】下列物质中,能在氯气中燃烧产生白色烟雾的是( )
A.金属铁B.金属钠C.氢气D.白磷
 同步练习强化拓展系列答案
同步练习强化拓展系列答案科目:高中化学 来源: 题型:
【题目】Cu粉放入稀H2SO4中,加热后无现象,当加入一种盐后,Cu粉质量减少,而溶液变蓝,同时有气体生成,此盐是
A.氯化物B.硫酸盐C.硝酸盐D.碳酸盐
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】未来新能源的特点是资源丰富,在使用时对环境无污染或污染很小,且可以再生。下列符合未来新能源标准的是( )
①天然气 ②煤 ③核能 ④石油 ⑤太阳能 ⑥生物质能 ⑦风能 ⑧氢能
A.①②③④B.⑤⑥⑦⑧C.③⑤⑥⑦⑧D.③④⑤⑥⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各项中正确的是( )
A. 已知H+(aq)+OH-(aq) == H2O(l) ΔH=-57.3 kJ·mol-1,则H2SO4和Ba(OH)2反应的反应热 ΔH=2×(-57.3) kJ·mol-1
B. 已知CH3OH(g)+1/2O2(g) == CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1,则CH3OH(g)的燃烧热为192.9 kJ·mol-1
C. H2(g)的燃烧热是285.8 kJ·mol-1 ,则2H2O(g) == 2H2(g)+O2(g) ΔH=+571.6 kJ·mol-1
D. 葡萄糖的燃烧热是2800 kJ·mol-1,则1/2C6H12O6(s)+3O2(g) == 3CO2(g)+3H2O(l) ΔH=-1400 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA是阿伏加德罗常数的值,下列说法正确的是( )
A. 22.4 L(标准状况)氩气含有的质子数为18NA
B. 16.25 g FeCl3水解形成的Fe(OH)3胶体粒子数为0.1 NA
C. 92.0 g甘油(丙三醇)中含有羟基数为1.0NA
D. 1.0 mol CH4与Cl2在光照下反应生成的CH3Cl分子数为1.0NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)反应Fe(s)+CO2(g)![]() FeO(s)+CO(g) ΔH1,平衡常数为K1;反应Fe(s)+H2O(g)
FeO(s)+CO(g) ΔH1,平衡常数为K1;反应Fe(s)+H2O(g)![]() FeO(s)+H2(g) ΔH2,平衡常数为K2;在不同温度时K1、K2的值如下表:
FeO(s)+H2(g) ΔH2,平衡常数为K2;在不同温度时K1、K2的值如下表:
700 ℃ | 900 ℃ | |
K1 | 1.47 | 2.15 |
K2 | 2.38 | 1.67 |
①反应CO2(g)+H2(g)![]() CO(g)+H2O(g) ΔH的平衡常数为K,则ΔH=________(用ΔH1和ΔH2表示),K=________(用K1和K2表示),且由上述计算可知,反应CO2(g)+H2(g)
CO(g)+H2O(g) ΔH的平衡常数为K,则ΔH=________(用ΔH1和ΔH2表示),K=________(用K1和K2表示),且由上述计算可知,反应CO2(g)+H2(g)![]() CO(g)+H2O(g)是_____________________反应(填“吸热”或“放热”)。
CO(g)+H2O(g)是_____________________反应(填“吸热”或“放热”)。
②能判断CO2(g)+H2(g)![]() CO(g)+H2O(g)达到化学平衡状态的依据是_______(填字母)。
CO(g)+H2O(g)达到化学平衡状态的依据是_______(填字母)。
A.容器中压强不变 B.混合气体中c(CO)不变
C.v正(H2)=v逆(H2O) D.c(CO)=c(CO2)
(2)一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,发生反应:Fe(s)+CO2(g)![]() FeO(s)+CO(g) ΔH>0,CO2的浓度与时间的关系如图所示。
FeO(s)+CO(g) ΔH>0,CO2的浓度与时间的关系如图所示。

①该条件下反应的平衡常数为______;若铁粉足量,CO2的起始浓度为2.0 mol·L-1,则平衡时CO2的浓度为______mol·L-1。
②下列措施中能使平衡时 增大的是________(填字母)。
增大的是________(填字母)。
A.升高温度 B.增大压强
C.充入一定量的CO2 D.再加入一定量铁粉
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丙烯是重要的有机化工原料,丙烷脱氢制丙烯具有显著的经济价值和社会意义。反应原理如下:C3H8(g)![]() C3H6(g)+H2(g) △H1
C3H6(g)+H2(g) △H1
(1)一定温度下,向 10 L 恒容密闭容器中充入 2 mol C3H8 发生反应,经过 10 min达到平衡状态,测得平衡时气体压强是开始的 1.75 倍。
①0 ~ 10 min内丙烯的生成速率υ(C3H6) =_________,C3H8 的平衡转化率为__________。
②下列情况能说明该反应达到平衡状态的是___________。
A.气体密度保持不变 B.[c(C3H6)·c(H2)]/c(C3H8)保持不变
C.△H1 保持不变 D.C3H8 分解速率与 C3H6 消耗速率相等
(2)总压强分别为 p1 和 p2 时,上述反应在不同温度下达到平衡,测得丙烷及丙烯的物质的量分数如下图所示:
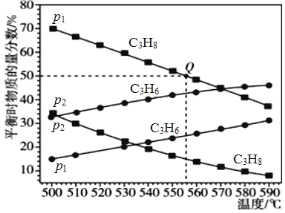
①压强:p1_____(填“>”或“<”)p2。
②为了提高反应速率和反应物的转化率,可采取的措施是_____。
③若 p1 = 0.1 MPa,起始时充入一定量的丙烷发生反应,计算 Q 点对应温度下该反应的平衡常数 Kp =_____(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
④在 0.1 MPa、527℃条件下,向恒容密闭容器中通入丙烷和稀有气体,发生丙烷脱氢反应,随着![]() 的增加,丙烷脱氢转化率逐渐增大。试解释原因__________________________。
的增加,丙烷脱氢转化率逐渐增大。试解释原因__________________________。
(3)在实际生产中,还可能存在如下副反应:
C3H8(g)![]() C2H4(g)+CH4(g) △H2 = +81.7 kJ/mol
C2H4(g)+CH4(g) △H2 = +81.7 kJ/mol
C2H4(g)+H2(g)![]() C2H6(g) △H3
C2H6(g) △H3
C3H8(g) +H2(g)![]() CH4(g)+C2H6(g) △H4 = -54.8 kJ/mol
CH4(g)+C2H6(g) △H4 = -54.8 kJ/mol
则△H3=_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应C(s)+H2O(g)![]() CO(g)+H2(g)在一定容积的密闭容器中进行,则下列说法或结论中,能够成立的是( )
CO(g)+H2(g)在一定容积的密闭容器中进行,则下列说法或结论中,能够成立的是( )
A. 其他条件不变仅将容器的体积缩小一半,反应速率减小
B. 保持体积不变,充入少量He气体使体系压强增大,反应速率一定增大
C. 反应达平衡状态时:v(CO)正=v(H2O)逆
D. 其他条件不变,适当增加C(s)的质量会使反应速率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,改变醋酸溶液的pH[溶液中c(CH3COOˉ)与c(CH3COOH)之和始终为0.1mol·Lˉ1],溶液中H+、OHˉ、CH3COOˉ及CH3COOH浓度的对数值(lgc)与pH关系如图所示。

下列说法错误的是
A. lgK(CH3COOH)=-9.26
B. 图中①表示 CH3COOH浓度的对数值与pH的关系曲线
C. 0.1mol·Lˉ1CH3COOH溶液的pH约为2.88
D. 0.1mol·Lˉ1CH3 COONa溶液的pH约为8.87
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com