
【题目】氮的氧化物(NOx)是大气污染物之一,工业上在一定温度和催化剂条件下用NH3将NOx还原生成N2。玉溪一中化学兴趣小组在实验室中对NH3与NO2反应进行了探究。回答下列问题:
(1)氨气的制备

①氨气的发生装置可以选择上图中的________,反应的化学方程式为____________________。
②欲收集一瓶干燥的氨气,选择上图中的装置,其连接顺序为:发生装置→_____________(按气流方向,用小写字母表示)。
(2)氨气与二氧化氮的反应
将上述收集到的NH3充入注射器X中,硬质玻璃管Y中加入少量催化剂,充入NO2(两端用夹子K1、K2夹好)。在一定温度下按图示装置进行实验。

操作步骤 | 实验现象 | 解释原因 |
打开K1,推动注射器活塞,使X中的气体缓慢通入Y管中 | ①Y管中____________ | ②反应的化学方程式______,该反应中被氧化和被还原的氮元素的质量比是____________ |
将注射器活塞退回原处并固定,待装置恢复到室温 | Y管中有少量水珠 | 生成的气态水凝聚 |
打开K2 | ③____________ | ④______________ |
【答案】 A 2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O (或B NH3·H2O
CaCl2+2NH3↑+2H2O (或B NH3·H2O![]() NH3↑+H2O) d→c→f→e→i 红棕色慢慢变浅 8NH3+6NO2
NH3↑+H2O) d→c→f→e→i 红棕色慢慢变浅 8NH3+6NO2![]() 7N2+12H2O 4:3 Z中NaOH溶液产生倒吸现象 反应后气体分子数减少,装置中压强减小
7N2+12H2O 4:3 Z中NaOH溶液产生倒吸现象 反应后气体分子数减少,装置中压强减小
【解析】(1)①由于制取氨气可以用2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O,故可以选A装置或利用NH3·H2O
CaCl2+2NH3↑+2H2O,故可以选A装置或利用NH3·H2O![]() NH3↑+H2O制取NH3,故也可以选B装置;正确答案:A ,2NH4Cl+Ca(OH)2
NH3↑+H2O制取NH3,故也可以选B装置;正确答案:A ,2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O ;或B,NH3·H2O
CaCl2+2NH3↑+2H2O ;或B,NH3·H2O![]() NH3↑+H2O。
NH3↑+H2O。
②生成的NH3中混有水蒸气,且氨气是碱性气体,可用碱石灰干燥,用向下排空气法收集,在收集装置后,需用防倒吸的尾气处理装置;正确的连接顺序为d→c→f→e→i ;正确答案:d→c→f→e→i。
(2)①氨气与二氧化氮发生反应,消耗了二氧化氮,使Y管内红棕色颜色变浅;正确答案:红棕色慢慢变浅。
②二氧化氮具有强氧化性,氨气具有还原性,二氧化氮中氮元素由+4价降至0价,氨气中氮元素由-3价生成0价,生成氮气,故化学方程式为:8NH3+6NO2![]() 7N2+12H2O;该反应中被氧化和被还原的氮元素的物质的量之比为8:6,质量比是8×14:6×14=4:3;正确答案:8NH3+6NO2
7N2+12H2O;该反应中被氧化和被还原的氮元素的物质的量之比为8:6,质量比是8×14:6×14=4:3;正确答案:8NH3+6NO2![]() 7N2+12H2O;4:3。
7N2+12H2O;4:3。
③由于反应前后气体体积减小,Y管中压强小于外压,水倒吸入Y管中;正确答案: Z中NaOH溶液产生倒吸现象。
④由于该反应是气体体积减少的反应,装置内压强降低,在大气压的作用下发生倒吸;正确答案:反应后气体分子数减少,装置中压强减小。


科目:高中化学 来源: 题型:
【题目】某化学兴趣小组利用以下装置探究氯气与氨气之间的反应。其中A、F分别为氨气和氯气的发生装置,C为纯净干燥的氯气与氨气发生反应的装置。回答下列问题:
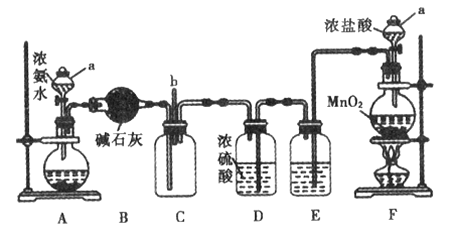
(1)仪器a的名称为__________。装置A的圆底烧瓶中盛放的固体物质可选用_____(填序号)
a.碱石灰 b.氢氧化钠 c.碳酸钙 d. 氧化钙固体
(2)从装置C的b处逸出的尾气中含有少量Cl2,为防止其污染环境,可将尾气通过盛有____溶液的洗气瓶。
(3)装置F的圆底烧瓶中发生反应的离子方程式为_______________________。装置E的作用是除去Cl2中的HCl,洗气瓶中盛放的试剂为_________________
(4)反应过程中,装置C的集气瓶中有大量白烟产生,另一种产物为N2。该反应的化学方程式为___________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯雷他定是缓解过敏症状的药物,其分子结构简式如图,说法正确的是( ) 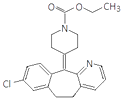
A.该分子中存在肽键
B.最多可以有12个碳原子共平面
C.1 mol氯雷他定最多可与8 mol氢气发生加成反应
D.能与NaOH溶液反应,但不能与NaHCO3溶液反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于含氮化合物的说法不正确的是
A.工业上可使用液氮做制冷剂B.NO2 能导致“光化学烟雾"的形成
C.浓硝酸可用铝槽车运输D.硫酸铁又称肥田粉,属于硝态氮肥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是( )
A.苯酚与碳酸氢钠溶液混合:C6H5OH+HCO ![]() →C6H5O﹣+CO2↑+H2O
→C6H5O﹣+CO2↑+H2O
B.向FeBr2溶液中通入等量Cl2:2Fe2++2Br﹣+2Cl2→2Fe3++Br2+4Cl﹣
C.将Al投入NaOH的重水溶液:2Al+2OH﹣+2D2O→2AlO ![]() +3D2↑
+3D2↑
D.Ca(HCO3)2溶液中加入足量的Ba(OH)2溶液:Ca2++2HCO ![]() +2OH﹣→CaCO3↓+CO
+2OH﹣→CaCO3↓+CO ![]() +2H2O
+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱式碳酸铜是一种用途广泛的化工原料,实验室以废铜屑为原料制取碱式碳酸铜的步骤如下:
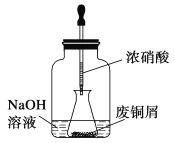
步骤一:废铜屑制硝酸铜
如图,用胶头滴管吸取浓硝酸缓慢加到锥形瓶内的废铜屑中(废铜屑过量),充分反应后过滤,得到硝酸铜溶液。
步骤二:碱式碳酸铜的制备
向大试管中加入碳酸钠溶液和硝酸铜溶液,水浴加热至70 ℃左右,用0.4 mol·L-1的NaOH溶液调节pH至8.5,振荡,静置,过滤,用热水洗涤,烘干,得到碱式碳酸铜产品。
完成下列填空:
(1)写出浓硝酸与铜反应的离子方程式___________________________________________。
(2)上图装置中NaOH溶液的作用是_________________________。
(3)步骤二中,水浴加热所需仪器有________、________(加热、夹持仪器、石棉网除外),水浴加热的优点是_______________________。
(4) 已知:CuCO3、Cu(OH)2受热均易分解,产物中都有CuO生成。碱式碳酸铜可表示为xCuCO3·yCu(OH)2·zH2O(x、y、z取整数),测定碱式碳酸铜组成的方法有多种,现采用氢气还原法,请回答如下问题:(已知M(Cu)=63.5 g·mol-1)。
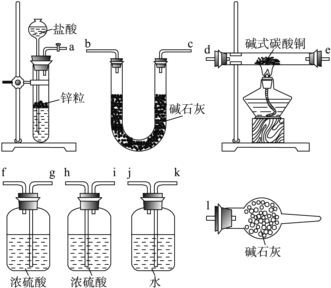
①写出xCuCO3·yCu(OH)2·zH2O与氢气反应的化学方程式:__________________;
②实验装置用上面所有仪器连接而成,按氢气流方向的连接顺序是(填入仪器接口字母编号):( a )→( )( )→( )( )→( )( )→( )( )→( )( )→( l )_____
③称取23.9 g某碱式碳酸铜样品,充分反应后得到12.7 g残留物,生成4.4 g二氧化碳和7.2 g水。该样品的结晶水质量为______ g,化学式为____________。
④某同学以氮气代替氢气,并用上述全部或部分仪器来测定碱式碳酸铜的组成,你认为是否可行?__________(填“可行”或“不可行”)请说明理由________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2015年诺贝尔奖获得者屠呦呦提取的抗疟新药青蒿素的结构简式,用键线式表示如图.
(1)青蒿素的分子式为 .
(2)为了引入过氧基 ![]() ,需要在有机合成中引入羟基,引入羟基的反应类型有(选填编号)
,需要在有机合成中引入羟基,引入羟基的反应类型有(选填编号)
①取代 ②加成 ③消去 ④酯化 ⑤还原
(3)步骤①③的作用是 .
(4)C8H10O3的结构简式: .
(5)C与这种天然香草醛互为同分异构体,写出符合下列条件的C的一种结构简式 .
①有苯环;②能水解;③能发生银镜反应;④遇FeCl3溶液发生显色反应.
(6)苄基乙醛 ![]() 是合成青蒿素的中间原料之一,写出由苯甲醛和氯乙烷为原料,制备苄基乙醛的合成路线流程图(无机试剂任用) . 已知:羰基α﹣H可发生反应:
是合成青蒿素的中间原料之一,写出由苯甲醛和氯乙烷为原料,制备苄基乙醛的合成路线流程图(无机试剂任用) . 已知:羰基α﹣H可发生反应: ![]()

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列电离方程式正确的是( )
A. MgSO4=Mg+2+SO4-2
B. Ba(OH)2=Ba2++OH2-
C. Al2(SO4)3=2Al3++3SO42-
D. KClO3=K++Cl-+3O2-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某强酸性溶液X含有Ba2+、Al3+、NH![]() 、Fe2+、Fe3+、CO
、Fe2+、Fe3+、CO![]() 、SO
、SO![]() 、SO
、SO![]() 、Cl-、NO
、Cl-、NO![]() 中的一种或几种,取该溶液进行实验,实验内容如下:
中的一种或几种,取该溶液进行实验,实验内容如下:
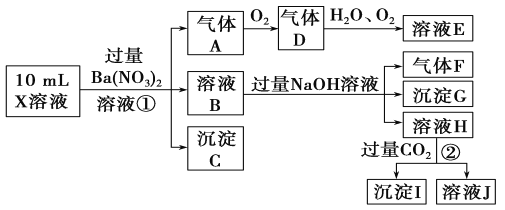
根据以上信息,回答下列问题:
(1)溶液X中除H+外还肯定含有的离子是________________________________;可能存在的离子是______________________________;
(2)写出有关离子方程式:步骤①中生成A__________________________;步骤②生成沉淀I___________________________________________。
(3)假设测定A、F、I均为0.01 mol,10 mL X溶液中n(H+)=0.04 mol,而沉淀C物质的量为0.07 mol,能说明该溶液不能确定的阴离子存在的理由是______________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com