
| A. | =196.64kJ | B. | =98.32kJ | C. | <196.64kJ | D. | >196.64kJ |
分析 根据热化学方程式得出生成1molSO3时放出的热量,利用极限法计算出2mol SO2和1molO2反应生成SO3的物质的量,计算放出的热量,由于可逆反应的不完全性,所以放出的热量小于按极限法计算放出的热量.
解答 解:根据热化学方程式SO2(g)+$\frac{1}{2}$O2(g)?SO3(g)△H=-98.32kJ•mol-1的含义,可知SO2和O2反应生成1molSO3时放出的热量为98.32kJ,所以生成2molSO3时放出的热量为196.64kJ,由于是可逆反应,2mol SO2和1molO2不能完全反应,所以放出的热量小于196.64kJ.
故选C.
点评 本题考查可逆反应的特点,难度不大,明确热化学方程式的意义是解题的关键.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 1 mol强酸和1 mol强碱完全反应所放出的热量称为中和热 | |
| B. | 热化学方程式中表明的热量是指每摩尔反应物反应时吸收或放出的热量 | |
| C. | 1 mol碳燃烧所放出的热量为燃烧热 | |
| D. | 热化学方程式中的化学计量数表示物质的量,因此可用分数表示 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H+、Na+、NO3-、CO32- | B. | H+、Na+、ClO-、Cl- | ||
| C. | K+、HCO3-、Cl-、OH- | D. | Na+、Mg2+、NO3-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 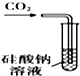 甲装置:可用来证明碳酸的酸性比硅酸强 | |
| B. | 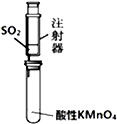 乙装置:可用来检验二氧化硫气体 | |
| C. | 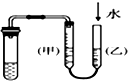 丙装置:用图示的方法不能检查此装置的气密性 | |
| D. |  丁装置:先从①口进气集满二氧化碳,再从②口进气,可收集氢气 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | ① | B. | ② | C. | ③ | D. | ④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 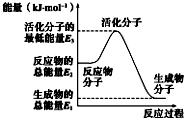 反应②中的能量变化如图所示,则△H2=E1-E3 | |
| B. | N2的燃烧热为180kJ•mol-1 | |
| C. | 由反应②知在温度一定的条件下,在一恒容密闭容器中通入1 mol N2和 3 mol H2,反应后放出的热量为Q1 kJ,若通入2 mol N2和 6 mol H2反应后放出的热量为Q2 kJ,则184.8>Q2>2Q1 | |
| D. | 氨的催化氧化反应为 4NH3(g)+5O2(g)═4NO(g)+6H2O(g)△H=+906 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
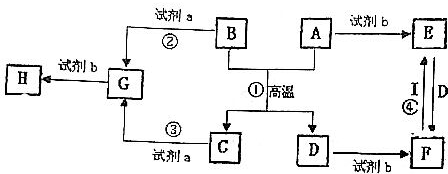
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
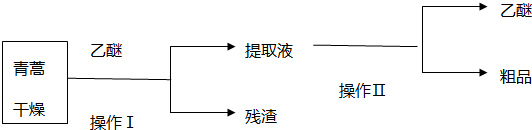
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由强极性键形成的化合物不一定是强电解质 | |
| B. | 强电解质溶液的导电能力一定比弱电解质溶液强 | |
| C. | NaCl溶液在电流的作用下电离成钠离子和氯离子 | |
| D. | 氯化钠晶体不导电是由于氯化钠晶体中不存在离子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com