
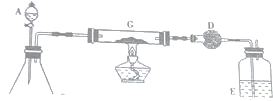
| A. | 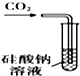 甲装置:可用来证明碳酸的酸性比硅酸强 | |
| B. | 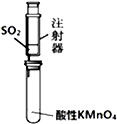 乙装置:可用来检验二氧化硫气体 | |
| C. | 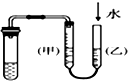 丙装置:用图示的方法不能检查此装置的气密性 | |
| D. |  丁装置:先从①口进气集满二氧化碳,再从②口进气,可收集氢气 |
分析 A.碳酸的酸性大于硅酸,可生成硅酸沉淀;
B.二氧化硫具有还原性,可被高锰酸钾氧化;
C.利用压强差检验装置的气密性;
D.根据气体的溶解性及密度确定收集方法.
解答 解:A.二氧化碳和水反应生成碳酸,碳酸酸性大于硅酸,所以二氧化碳和硅酸钠溶液反应生成不溶性硅酸,则该装置能证明碳酸的酸性比硅酸强,故A正确;
B.二氧化硫具有还原性,可被高锰酸钾氧化,高锰酸钾溶液褪色,可检验二氧化硫气体,故B正确;
C.如果装置的气密性良好,甲、乙两侧水面高度不同,否则水面相同,所以能检验装置的气密性,故C错误;
D.二氧化碳的密度大于空气、氢气的密度小于空气,所以氢气采用向下排空气法收集、二氧化碳采用向上排空气法收集,故D正确;
故选C.
点评 本题考查了化学实验方案设计,涉及非金属性强弱的判断、气密性检验、气体的收集方法等知识点,明确实验原理是解本题关键,根据强酸制取弱酸、气体的密度等知识点来分析解答,易错选项是B.


 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案 初中暑期衔接系列答案
初中暑期衔接系列答案科目:高中化学 来源: 题型:选择题
| A. | 0.2mol | B. | 0.6mol | C. | 0.8mol | D. | l.0mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 反应物的键能总和比生成物的键能总和高 | |
| B. | E1为反应物的平均能量与过渡态的能量差,称为正反应的活化能 | |
| C. | 正反应的热效应为△H=E1-E2,且E2>E1,所以正反应为放热反应 | |
| D. | 使用合适的催化剂能同时降低E1和E2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
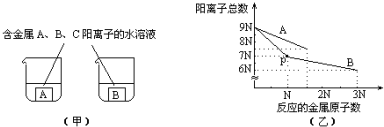
| A. | ① | B. | ② | C. | ①③ | D. | ②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,2.24LNO2分子总数小于0.1NA | |
| B. | 50ml,18.4 mol/L浓硫酸与足量铜微热反应,生成SO2分子的数目为0.46NA | |
| C. | 标准状况下,33.6 L氟化氢中含有氟原子的数目为1.5NA | |
| D. | 6.8g液态KHSO4中含有0.1NA个阳离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
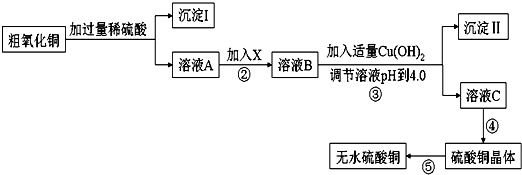
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | =196.64kJ | B. | =98.32kJ | C. | <196.64kJ | D. | >196.64kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
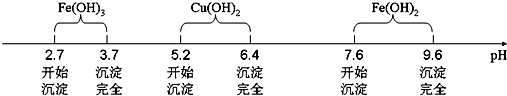
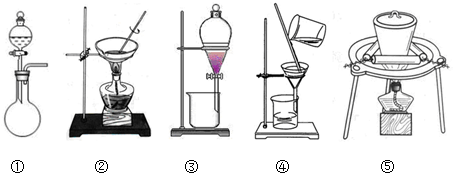
| 滴定次数 | 第一次 | 第二次 | 第三次 |
| 滴定前读数(mL) | 0.10 | 0.36 | 1.10 |
| 滴定滴定后读数(mL) | 20.12 | 20.34 | 22.12 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 配制1L0.1mol/LNaCl溶液的实验中,用托盘天平称取5.85gNaCl | |
| B. | 用广泛pH试纸测得橙汁pH为3.50 | |
| C. | 用酸式滴定管量取25.00mL高锰酸钾溶液 | |
| D. | 可用过滤的方法除去淀粉溶液中混有的少量NaCl杂质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com