
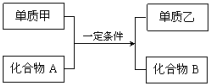
 单质A、B、C与化合物甲、乙之间有如图所示的转化关系(部分产物已省略).
单质A、B、C与化合物甲、乙之间有如图所示的转化关系(部分产物已省略).分析 由A是金属单质、乙与A发生的反应属于置换反应,可知A为Mg时,B为氧气,C为C,乙为CO2;A为Al时,B为氧气,C为Fe,乙为四氧化三铁;A为Fe时,B为氧气,C为氢气,乙为水,以此来解答.
解答 解:由A是金属单质、乙与A发生的反应属于置换反应,可知A为Mg时,B为氧气,C为C,乙为CO2;A为Al时,B为氧气,C为Fe,乙为四氧化三铁;A为Fe时,B为氧气,C为氢气,乙为水,则乙与A反应的化学方程式为2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$2MgO+C或3Fe3O4+8Al$\frac{\underline{\;高温\;}}{\;}$4Al2O3+9Fe或3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2↑,
故答案为:2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$2MgO+C;3Fe3O4+8Al$\frac{\underline{\;高温\;}}{\;}$4Al2O3+9Fe;3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2↑.
点评 本题考查无机物的推断,为高频考点,把握元素化合物的性质、相互转化为解答的关键,侧重分析与推断能力的考查,注意元素化合物的性质,题目难度不大.


科目:高中化学 来源: 题型:解答题
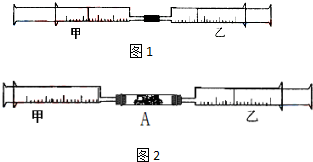 如图1所示,将甲、乙两个装有不同物质的针筒用导管连接起来,将乙针筒内的物质缓缓地压到甲针筒内,进行下表所列的不同实验(气体体积在常温常压下测定).
如图1所示,将甲、乙两个装有不同物质的针筒用导管连接起来,将乙针筒内的物质缓缓地压到甲针筒内,进行下表所列的不同实验(气体体积在常温常压下测定).| 实验序号 | 甲针筒内物质 | 乙针筒内物质 | 甲针筒的现象 |
| 1 | 40mL HCl | 40mL NH3 | 产生白烟 |
| 2 | 40mL Cl2 | 10mL 水 | 剩余气体为20mL |
| 3 | 30mL NO | 15mL O2 | |
| 4 | 20mL AlCl3溶液 | 10mL NaOH溶液 | 生成白色沉淀,后消失 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2能使酸性KMnO4溶液褪色,故CO2也能使酸性KMnO4溶液褪色 | |
| B. | 盐酸与镁反应生成氢气,故硝酸与镁反应也生成氢气 | |
| C. | SO2能使品红溶液褪色,故CO2也能使品红溶液褪色 | |
| D. | 常温下浓硫酸能使铁和铝钝化,故常温下浓硝酸也能使铁和铝钝化 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
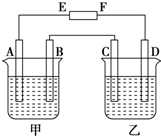 在图中,E和F分别为电源两极;甲烧杯中盛有100mL 0.2mol•L-1 AgNO3溶液,乙烧杯中盛有100mL 0.15mol•L-1 CuCl2溶液,A、B、C、D均为石墨电极,如果电解一段时间后,发现B极增重1.08g,则
在图中,E和F分别为电源两极;甲烧杯中盛有100mL 0.2mol•L-1 AgNO3溶液,乙烧杯中盛有100mL 0.15mol•L-1 CuCl2溶液,A、B、C、D均为石墨电极,如果电解一段时间后,发现B极增重1.08g,则查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 置换反应的通式可表示为:
置换反应的通式可表示为:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com