
����Ŀ��CO2��ת���������������о�����Ҫ��Ӧ�á�
��CO2�ĵ�̼ת�ͶԵ�������仯������Ҫ���塣
��1�������ǵ�����̼Ԫ�ص���������ճ�����
�����ں�ˮ�е�CO2��Ҫ��������̼��ʽ���ڣ���CO2��H2CO3���ַ����⣬�����������ӵĻ�ѧʽΪ____________��
���ں���̼ѭ���У���ͨ����ͼ��ʾ��;����̼��д���ƻ����õ����ӷ���ʽ��_____________��

��2����CO2������������Ƴ�Na��CO2��أ�������ʵ�ֿ���ij䡢�ŵ練Ӧ���õ�ط�ӦΪ4Na��3CO2 ![]() 2Na2CO3��C���ŵ�ʱ���������õ��ӵ�����Ϊ______�����ʱ�������ķ�ӦʽΪ_____��
2Na2CO3��C���ŵ�ʱ���������õ��ӵ�����Ϊ______�����ʱ�������ķ�ӦʽΪ_____��
���������е��к����ʳ�ͨ��ת��ΪCO2��������Ⱦ��
��3��TiO2��һ�����������İ뵼������������Ч�ؽ��л���Ⱦ��ת��ΪCO2��С�������ʡ���ͼΪ��TiO2�Ĵ��£�O3����CH3CHO��ʾ��ͼ����÷�Ӧ�Ļ�ѧ����ʽΪ____��

��4���������ѻ�����PbO2���缫�ɽ���������Ƚ���ΪCO2 ��H2O���õ缫��ͨ����������Ʊ������ѻ����ñ�ͪ���ݺ�����ˮ��ϴ�����Ѱ��϶���һ����Ĥ�������������ڲ�����Һ�е�⣬һ��ʱ�����������Ϊ��������ͬʱ�γɿ�������Pb(NO3)2��Һ����������PbO2����ȥ�����������������ѻ�����PbO2�缫��
���ñ�ͪ���ݵ�Ŀ����______��
�����ʱ������ǿ�Ⱥͻ���������ʱ��仯��ͼ��ʾ���������յ����ͻȻ���ӵ�ԭ����______��

���𰸡�HCO3����CO32��Ca2����2HCO3��=CaCO3����CO2����H2OCO2C��4e����2CO32����3CO25O3��3CH3CHO![]() 6CO2��6H2O��ȥ�ѻ�������л�����ۣ����������ʱ���γɵĿ���������ѵı��棬�����ѵ�������ǿ
6CO2��6H2O��ȥ�ѻ�������л�����ۣ����������ʱ���γɵĿ���������ѵı��棬�����ѵ�������ǿ
��������
I.��1��.��.���ں�ˮ�е�CO2��Ҫ��������̼��ʽ���ڣ���CO2��H2CO3���ַ����⣬�����������ӣ��ֱ�ΪCO32-��HCO3-����.����ͼ1��ת����ʽ�������ƻ����ù�������HCO3-ͨ���ƻ���������CaCO3����֪Ca2+��HCO3-�ڴ˷�Ӧ������CaCO3���ݴ�д����Ӧ�����ӷ���ʽ��
��2��.��ط�ӦΪ4Na��3CO2 ![]() 2Na2CO3��C���ŵ�ʱΪԭ��ط�Ӧ��ԭ������������ʵõ��ӣ�������ԭ��Ӧ���ݴ��жϣ����ʱΪ���ط�Ӧ����������ʧȥ���ӣ�����������Ӧ������ܷ�Ӧʽд�������ĵ缫��Ӧ����ʽ��
2Na2CO3��C���ŵ�ʱΪԭ��ط�Ӧ��ԭ������������ʵõ��ӣ�������ԭ��Ӧ���ݴ��жϣ����ʱΪ���ط�Ӧ����������ʧȥ���ӣ�����������Ӧ������ܷ�Ӧʽд�������ĵ缫��Ӧ����ʽ��
II.��3�����������֪����������ȩ�������ߵ����������ɶ�����̼��ˮ���ݴ���д��ѧ����ʽ��
��4��.��.�ñ�ͪ���ݵ�Ŀ���dz�ȥ�ѻ�������л�����ۣ�����.���������ʱ���γɵĿ���������ѵı��棬�����ѵ�������ǿ��
I. (1).��.���ں�ˮ�е�CO2��Ҫ��������̼��ʽ��������CO2��H2CO3���ַ����������������������ֱ�ΪCO32��HCO3���ʴ�Ϊ��HCO3��CO32��
��.����ͼ1��ת����ʽ�������ڸƻ����ù�����HCO3ͨ���ƻ���������CaCO3��֪��Ca2+��HCO3�ڴ˷�Ӧ������CaCO3����Ӧ�����ӷ���ʽΪ��Ca2����2HCO3��=CaCO3����CO2����H2O���ʴ�Ϊ��Ca2����2HCO3��=CaCO3����CO2����H2O��
(2).��ط�ӦΪ4Na��3CO2 ![]() 2Na2CO3��C���ŵ�ʱΪԭ��ط�Ӧ��ԭ������������ʵõ��ӷ�����ԭ��Ӧ����ŵ�ʱ�������õ��ӵ�����ΪCO2�����ʱΪ���ط�Ӧ����������ʧȥ���ӷ���������Ӧ�������ܷ�Ӧ����ʽ��֪��ӦΪCʧȥ���ӱ��CO2������ʱ�����ķ�ӦʽΪ��C��4e����2CO32����3CO2���ʴ�Ϊ��CO2��C��4e����2CO32����3CO2��
2Na2CO3��C���ŵ�ʱΪԭ��ط�Ӧ��ԭ������������ʵõ��ӷ�����ԭ��Ӧ����ŵ�ʱ�������õ��ӵ�����ΪCO2�����ʱΪ���ط�Ӧ����������ʧȥ���ӷ���������Ӧ�������ܷ�Ӧ����ʽ��֪��ӦΪCʧȥ���ӱ��CO2������ʱ�����ķ�ӦʽΪ��C��4e����2CO32����3CO2���ʴ�Ϊ��CO2��C��4e����2CO32����3CO2��
II. (3).���������֪����������ȩ�������ߵ����������ɶ�����̼��ˮ����ѧ����ʽΪ5O3��3CH3CHO![]() 6CO2��6H2O���ʴ�Ϊ��5O3��3CH3CHO
6CO2��6H2O���ʴ�Ϊ��5O3��3CH3CHO![]() 6CO2��6H2O��
6CO2��6H2O��
(4).��.�ñ�ͪ���ݵ�Ŀ���dz�ȥ�ѻ�������л���(����)���ʴ�Ϊ����ȥ�ѻ�������л���(����)��
��.���ʱ������ǿ�Ⱥͻ���������ʱ��仯��ͼ��ʾ���������յ����ͻȻ���ӵ�ԭ�������������ʱ���γɵĿ���������ѵı��棬�����ѵ�������ǿ���ʴ�Ϊ�����������ʱ���γɵĿ���������ѵı��棬�����ѵ�������ǿ��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ԭ���������������ֶ�����Ԫ�أ�����ĸ x �ȱ�ʾ����ԭ�Ӱ뾶����Դ�С��������ۻ�����۵ı仯����ͼ��ʾ��

�����жϳ���Ԫ�ػش����⣺
��1��g �����ڱ��е�λ����__________��
��2��d��e��h �ļ����Ӱ뾶�ɴ�С˳��_____________(�����ӷ��ű�ʾ)��
��3���й� y��z��d ����Ԫ�ص�˵����ȷ����__________������ţ���
��������ۣ�d>z>y �ڼ���̬�⻯����ȶ��ԣ�d>z>y
�۷ǽ����ԣ�d>z>y �ܵ��ʻ����ԣ�y>z>d
��4������g ��h ����Ԫ����գ�
����������������Ӧˮ�����������ǿ������˳����____________��(�û�ѧʽ��ʾ)
��g2h2 ������ԭ�Ӷ����� 8 ���ӽṹ����д�������ʽ____________��
��5������д��x��d��e �γɻ������ˮ��Һ�뵥��f ��Ӧ�Ļ�ѧ����ʽ________________��
����֪������A��B ���� x��d��e��g ����Ԫ����ɣ���д��A ��B ��Ӧ�����ӷ���ʽ________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����¶�ѹǿ����ʱ��1mol NO2���·ֽ⣬����NO��O2���ﵽƽ��ʱ��������������ʵ�����Ϊ1.2mol����ʱNO2��ת����Ϊ
A. 10%B. 20%C. 40%D. 50%
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���±�ΪԪ�����ڱ���һ���֣������Ԫ�آ١����ڱ��е�λ�ã��ش��������⣺
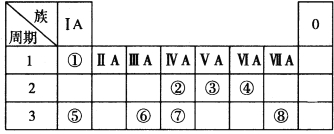
��1���ؿ��к������ڵڶ�λ��Ԫ�������ڱ��е�λ����____��
��2���ڵ����������ķ���ʽΪ_____���ߵ�����������Ӧˮ����ķ���ʽΪ__��
��3���١��ܡ�������Ԫ�ؿ��γɼȺ����Ӽ��ֺ����ۼ������ӻ�����û�����ĵ���ʽΪ_____��
��4��W�ǵ����������ͬ�����Ԫ�ء��ݴ��Ʋ�W�����ܾ��е�������___������ĸ��˫ѡ����
A����������ϼ�Ϊ+6
B����̬�⻯���H2S�ȶ�
C������������Ӧˮ��������Ա�������
D�������ڳ����¿�����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ˮ�м�������������(�¶Ȳ���)��������˵����ȷ���ǣ� ��
A.�ٽ���ˮ�ĵ���B.c(H��)��С
C.ˮ��c(H��)��c(OH��)�ij˻�����D.c(OH��)��С
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���й��Ȼ�ѧ����ʽ��д���Ӧ��������ȷ����
A. ϡ������0.1 mol/L NaOH ��Һ��Ӧ��H+(aq)+OH��(aq)= H2O(l) ��H = +57.3 kJ��mol1
B. ��֪ 2C(s)+O2(g)=2CO(g)��H= -221 kJ��mol-1����C��ȼ����Ϊ��H =- 110.5 kJ��mol1
C. 25�桢30MPa �£��� 0.5mol N2 �� 1.5molH2 �����ܱյ������г�ַ�Ӧ����NH3(g)������ 19.3kJ�� ���Ȼ�ѧ����ʽΪ��N2(g) + 3H2(g) ![]() 2NH3(g) ��H= -38.6kJ��mol1
2NH3(g) ��H= -38.6kJ��mol1
D. �ܱ������У�0.3mol ����� 0.2mol ���ۻ�ϼ������������� 0.2mol ʱ���ų� 19.12 kJ ������ �� Fe(s)+S(s)=FeS(s)��H= - 95.6 kJ��mol1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ͼ�dz��������IJ��ֽṹ��

��1�����������A__________��B__________��C__________��D__________��
��2��ʹ��ǰ�����Ƿ�©ˮ��������____________������ĸ����
������֪������������ͭ��Ksp=2��10-20��
��3��ij����ͭ��Һ��c(Cu2+)=0.02mol/L����Ҫ����Cu(OH)2������Ӧ������ҺpHʹ֮����_________��
��4��Ҫʹ0.2mol/ LCuSO4��Һ��Cu2+������Ϊ��ȫ��Cu2+Ũ�Ƚ���ԭ����ǧ��֮һ������Ӧ����Һ�����NaOH��Һʹ��ҺpHΪ______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ��̽����ѧ�������ܵ�ת����ijʵ��С���������ͼ��ʾ������ʵ��װ�ã�
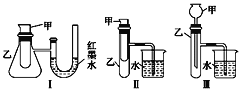
(1)����3��װ���У�����֤����ͭ��Ũ�� �ᷴӦ�����ȷ�Ӧ���Ƿ��ȷ�Ӧ������(�������ִ�����ʹ���¶ȼ�)___________��
(2)ijͬѧѡ��װ�â����ʵ��(ʵ��ǰU�ι���Һ��������ƽ)���ڼ��Թ������ ��������������Һ��ϡ���ᣬU�ι��пɹ۲쵽��������______________��˵���÷�Ӧ����_____ (��������������������)��Ӧ��
(3)Ϊ�����ⶨ(2)�з�Ӧ�ķ�Ӧ�ȣ�ʹ50 mL 0.50 mol��L��1������50 mL0.55 mol��L��1NaOH��Һ�ڼ������ȼ��н����кͷ�Ӧ.�ش��������⣺
�ٸ�ʵ����NaOH��Ũ�ȴ���HCl��Ũ�ȵ�������_________________________��
��ʵ����������60 mL 0.50 mol��L��1������50 mL 0.55 mol��L��1NaOH��Һ���з�Ӧ��������ʵ����ȣ������к���_________ (��������������������)��
(4)��֪һЩ��ѧ���ļ������������ʾ��
��ѧ�� | C��H | C��F | H��F | F��F |
����/kJ��mol��1 | 414 | 489 | 565 | 155 |
����ݼ������ݹ���CH4(g)��F2(g)��Ӧ����CF4(g)��HF(g)���Ȼ�ѧ����ʽ��_______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪Ԫ��Xλ��Y����һ���ڣ�X��Y��ԭ��������������20��ij�������μĻ�ѧʽ ΪXYO3����ش�
��1��������X�ĵ�������ˮ������Ӧ��395��ʱ�����ܷ����ֽⷴӦ���������Σ�һ���� ��YԪ�ص��������Σ���Xλ�����ڱ�_____�������ֽⷴӦ�Ļ�ѧ����ʽ��_____��
��2�� ����������ˮ���Ҽ������ᷴӦ������ʹƷ����Һ��ɫ�����壮
�����Ϊ_____���ѧʽ����������ʹ���Ը��������Һ��ɫ�� �÷�Ӧ�����ӷ���ʽΪ_____��
��X��Y�γɼ����Ӱ뾶��С��ϵΪ > �������ӷ��ű�ʾ����_________
��25��ʱ������ˮ�еij����ܽ�ƽ����������ͼ��ʾ����Ҫʹ��Һ X2�����ӳ�����ȫ���� YO32�����ӵ���СŨ��Ϊ_____mol��L��1��
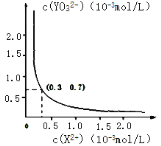
��������Ũ��С�� 1��10��5mol��L��1 ʱ�������ӳ�����ȫ��
��3�������������ᷴӦ��������ɫ����ζ�������ң�����
���ҵĵ���ʽΪ_____��
�ڼ���ˮ�г�����������һ�ָ����ܵ����ʲ��ݳ������ң��÷�Ӧ�Ļ�ѧ����ʽΪ___��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com