
| A、小苏打可用于治疗胃酸过多 |
| B、Cl2可与石灰乳反应制取漂白粉 |
| C、镁铝合金可用作制造飞机的材料 |
| D、铁制容器不能用于贮存浓硫酸 |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
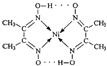 分子内的作用力除共价键外,还存在的两种作用力是
分子内的作用力除共价键外,还存在的两种作用力是 、④HCHO等,其中碳原子采取sp2杂化的分子有
、④HCHO等,其中碳原子采取sp2杂化的分子有
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、硅是非金属元素 |
| B、二氧化硅对应的水化物是可溶性弱酸 |
| C、二氧化硅能和强碱反应生成盐和水 |
| D、二氧化硅不能与酸反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、晶体硅是通信工程中制作光导纤维的主要原料,Na2SiO3常用来作木材防火剂. |
| B、漂白液是将氯气通入冷的消石灰[Ca(OH)2]中制得的,其有效成分为Ca(ClO)2 |
| C、酸雨是由于氮的氧化物和硫的氧化物的大量排放引起的,其中pH<5.6的为酸雨 |
| D、胃酸过多的病人可以服用氢氧化铝或者苏打来中和胃酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 硬质玻璃管是化学实验中经常使用的一种仪器,分析下列实验(固定装置略)并回答:
硬质玻璃管是化学实验中经常使用的一种仪器,分析下列实验(固定装置略)并回答:| 棉球 | 棉球上滴加试剂 | 实验现象 | 解释或结论 |
| a | 棉球变白, 微热后又恢复红色 | 解释: 结论:该气体具有漂白性. | |
| b | 含酚酞的NaOH溶液 | 棉球变为白色 | 离子方程式: |
| c | 棉球变为白色 | 化学方程式: 结论:该气体具有 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质 | X | Y | Z |
| 初始浓度/mol?L-1 | 0.1 | 0.2 | 0 |
| 平衡浓度/mol?L-1 | 0.05 | 0.05 | 0.1 |
| A、反应达到平衡时,X的转化率为50% |
| B、25℃时盖反应的平衡常数为1600(不考虑单位) |
| C、若Y的初始浓度变为0.3mol?L-1,则X与Y的转化率相等. |
| D、增大压强平衡将向生成Z的方向移动,平衡常数增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com