
| A. | 62g白磷(白磷P4为正四面体结构P原子位于顶点)中含P-P共价键为6NA | |
| B. | 1molCl2全部发生反应时,无论什么时候都是得到的电子数一定为2NA | |
| C. | 若一个CO的质量为a g,则CO的摩尔质量为a NA | |
| D. | 常温下10LpH=13的NaOH溶液中含有的OH-离子数为NA |
分析 A.P4分子中含6个P-P键,计算物质的量得到共价键数;
B.氯气参加反应,表现性质不同,转移电子数不同,据此判断;
C.摩尔质量以g/mol作单位,数值上等于该物质的相对分子质量或相对原子质量,据此计算;
D.pH=13的氢氧化钠溶液中氢氧根离子浓度为0.1mol/L,10L该氢氧化钠溶液中含有1mol氢氧根离子.
解答 解:A.62g白磷(白磷P4为正四面体结构P原子位于顶点)物质的量=$\frac{62g}{4×31g/mol}$=0.5mol,分子中含P-P共价键=0.5mol×6×NA=3NA,故A错误;
B.氯气参加反应,表现性质不同,转移电子数不同,例如氯气与水反应生成盐酸和次氯酸,Cl元素的化合价由0升高为+1价,Cl元素的化合价由0降低为-1价,1mol Cl2参加反应转移电子数为NA;1mol Cl2与铁反应生成氯化铁,氯气全部做氧化剂,1mol Cl2参加反应转移电子数为2NA;所以1mol Cl2参加反应转移电子数不一定为2NA,故B错误;
C.摩尔质量以g/mol为单位数值上等于相对原子质量,所以若一个CO的质量为a g,则CO的摩尔质量为a NAg/mol,故C错误;
D.pH=13的NaOH溶液中氢氧根离子浓度为0.1mol/L,10L该氢氧化钠溶液或者含有氢氧根离子1mol,含有的OH-离子数为NA,故D正确;
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
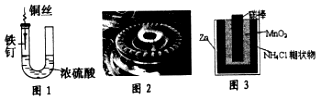
| A. | 图1中,铁钉易被腐蚀 | |
| B. | 图2中,燃气灶的中心部位容易生锈,主要是由于高温下铁发生化学腐蚀 | |
| C. | 图3中,Zn-MnO2干电池自放电腐蚀主要是由MnO2的氧化作用引起的 | |
| D. | 纯银器表面在空气中因电化学腐蚀渐渐变暗 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 胶体是一种分散系,属于混合物 | |
| B. | 胶体的本质特征是能发生丁达尔现象 | |
| C. | 胶体粒子直径介于1nm-100nm | |
| D. | 利用丁达尔现象是区分胶体和溶液的一种常用方法 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若Ⅰ达平衡时,A、B、C各增加1mol,则C转化率将一定增大 | |
| B. | 若向Ⅰ平衡体系中在加入1molA和3molB,C的体积分数若大于x,可断定n>3 | |
| C. | 若Ⅱ体系起始物质的量满足9a+c=3b,则可判断n=3 | |
| D. | 若n=2,则Ⅱ体系起始物质的量应满足2a+1<b<3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 11:2 | B. | 9:1 | C. | 9:4 | D. | 5:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4 L HF中含有的氟原子数目为NA | |
| B. | 0.1 mol/L的NH4HSO4溶液中滴加0.1 mol/L的Ba(OH)2溶液至沉淀刚好完全:c (NH4+)>c (OH-)>c (SO42-)>c (H+) | |
| C. | 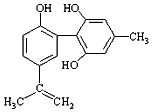 1mol如图物质与浓溴水反应时通常最多消耗Br2为4mol | |
| D. | 常温下,反应C(s)+CO2(g)=2CO(g)不能自发进行,则该反应的△H>0,一定条件下,使用催化剂能加快反应速率并提高反应 物的平衡转化率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 100ml0.1mol•L-1Na2SO4溶液中,微粒总数是0.03NA | |
| B. | 标准状况下,分子数为NA的N2、C2H4混合气体的质量无法确定 | |
| C. | 常温常压下,32g O2-中所含电子的数目为17NA | |
| D. | 标准状况下,11.2L酒精含有的分子数为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCl和NaOH反应的中和热△H=-57.3kJ/mol,则H2SO4和Ca(OH)2反应的中和热为2×(-57.3)kJ/mol | |
| B. | CO(g)的燃烧热是283.0 kJ/mol,则表示CO燃烧热的热化学方程式为:CO(g)+$\frac{1}{2}$O2(g)═CO2 (g)△H=-283.0 kJ/mol | |
| C. | 需要加热才能发生的反应一定是吸热反应 | |
| D. | 等物质的量的硫蒸气和硫固体分别完全燃烧,后者放出热量多 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com