
肼(N2H4)又称联氨,广泛用于火箭推进剂、有机合成及燃料电池,NO2的二聚体N2O4则是火箭中常用氧化剂。试回答下列问题:
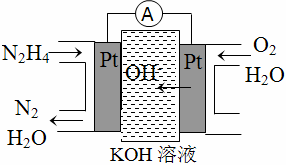
(1)肼燃料电池原理如图所示,左边电极上发生的电极反应式为____________________________________。
(2)火箭常用N2O4作氧化剂,肼作燃料,已知:
N2(g)+2O2(g) 2NO2(g) ΔH=-67.7kJ·mol-1
2NO2(g) ΔH=-67.7kJ·mol-1
N2H4(g)+O2(g) N2(g)+2H2O(g) ΔH=-534.0kJ·mol-1
N2(g)+2H2O(g) ΔH=-534.0kJ·mol-1
2NO2(g) N2O4(g) ΔH=-52.7kJ·mol-1
N2O4(g) ΔH=-52.7kJ·mol-1
试写出气态肼在气态四氧化二氮中燃烧生成氮气和气态水的热化学方程式:________________________________________________________________。
(3)联氨的工业生产常用氨和次氯酸钠为原料获得,也可在高锰酸钾催化下,尿素[CO(NH2)2]和次氯酸钠—氢氧化钠溶液反应获得,尿素法反应的离子方程式为_____________________________________________________。
(4)如图所示,A是由导热材料制成的密闭容器,B是一耐化学腐蚀且易于传热的透明气囊。关闭K2,将各1 mol NO2通过K1、K3分别充入A、B中,反应起始时A、B的体积相同均为a L。
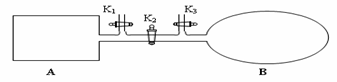
①B中可通过__________________________判断可逆反应2NO2 N2O4已经达到平衡。
N2O4已经达到平衡。
②若平衡后在A容器中再充入0.5mol N2O4,则重新到达平衡后,平衡混合气中NO2的体积分数________(填 “变大”、“变小”或“不变”)
③若容器A中到达平衡所需时间t s,达到平衡后容器内压强为起始压强的0.8倍,则平均化学反应速率v(NO2)等于____________________。
④若打开K2,平衡后B容器的体积缩至0.4a L,则打开K2之前,气球B体积为______L。
【答案】(1)N2H4-4e-+4OH- N2+4H2O
N2+4H2O
(2)2N2H4(g)+N2O4(g) 3N2(g)+4H2O(g) ΔH=-947.6 kJ· mol-1
3N2(g)+4H2O(g) ΔH=-947.6 kJ· mol-1
(3)CO(NH2)2+ClO-+2OH- N2H4+
N2H4+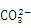 +Cl-+H2O
+Cl-+H2O
(4)①气囊B的体积不再减小或气体颜色不再变化
②变小;③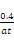 mol·L-1·s-1 ④0.7a
mol·L-1·s-1 ④0.7a
【解析】本题主要考查了原电池原理,电解池原理等考点的理解。(1)原电池中负极失去电子,正极得到电子。因此肼在负极通入,氧气在正极通入。又因为电解质是氢氧化钾,所以左侧即负极反应式是N2H4-4e-+4OH- N2+4H2O。(2)根据盖斯定律可知,②×2-①-③即得到反应式2N2H4(g)+N2O4(g)
N2+4H2O。(2)根据盖斯定律可知,②×2-①-③即得到反应式2N2H4(g)+N2O4(g) 3N2(g)+4H2O(g),所以该反应的反应热△H=-534. 0kJ·mol-1×2+67.7kJ·mol-1+52.7kJ·mol-1=-947.6 kJ·mol-1。(3)根据反应物和生成物可知,该反应的离子方程式是2NH3+ClO-
3N2(g)+4H2O(g),所以该反应的反应热△H=-534. 0kJ·mol-1×2+67.7kJ·mol-1+52.7kJ·mol-1=-947.6 kJ·mol-1。(3)根据反应物和生成物可知,该反应的离子方程式是2NH3+ClO- N2H4+Cl-+H2O。(4)①由于在反应过程中气体的体积是变化的,所以可以通过气囊B的体积变化来判断,又因为NO2是红棕色的气体,所以也可以通过气体颜色的变化来判断。即气囊B的体积不再减小或气体颜色不再变化时,即说明反应到达平衡状态。②由于反应物和生成物都是一种,所以再通入NO2,则相当于是增大压强,平衡向正反应方向移动,因此NO2的含量降低。③设消耗NO2的物质的量是x,则根据方程式2NO2
N2H4+Cl-+H2O。(4)①由于在反应过程中气体的体积是变化的,所以可以通过气囊B的体积变化来判断,又因为NO2是红棕色的气体,所以也可以通过气体颜色的变化来判断。即气囊B的体积不再减小或气体颜色不再变化时,即说明反应到达平衡状态。②由于反应物和生成物都是一种,所以再通入NO2,则相当于是增大压强,平衡向正反应方向移动,因此NO2的含量降低。③设消耗NO2的物质的量是x,则根据方程式2NO2 N2O4可知,生成N2O4的物质的量是x/2,则1-x+x/2=0.8,解得x=0.4mol,所以NO2的反应速率是
N2O4可知,生成N2O4的物质的量是x/2,则1-x+x/2=0.8,解得x=0.4mol,所以NO2的反应速率是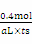 =
=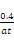 mol·L-1·s-1。④打开K2,则相当于是在等温等压时的平衡,因此平衡是等效的。由于此时反应物的物质的量是B中的二倍,所以打开K2之前,气球B体积为(aL+0.4aL)/2=0.7aL。
mol·L-1·s-1。④打开K2,则相当于是在等温等压时的平衡,因此平衡是等效的。由于此时反应物的物质的量是B中的二倍,所以打开K2之前,气球B体积为(aL+0.4aL)/2=0.7aL。


科目:高中化学 来源: 题型:
下列各组离子一定能大量共存的是( )
|
| A. | 在含大量Fe3+的溶液中:NH4+、Na+、Cl﹣、SCN﹣ |
|
| B. | 在强碱溶液中:Na+、K+、AlO2﹣、CO32﹣ |
|
| C. | 在c(H+)=10﹣13mol/L的溶液中:NH4+、Al3+、SO42﹣、NO3﹣ |
|
| D. | 在pH=0的溶液中:K+、Fe2+、Cl﹣、NO3﹣ |
查看答案和解析>>
科目:高中化学 来源: 题型:
用物质的量都是0.1 mol的CH3COOH和CH3COONa配制成1L混合溶液,已知其中c(CH3COO-)大于c(Na+)。对该混合溶液的下列判断正确的是
| A.c(OH-)>c(H+) | B.c(CH3COOH)+c(CH3COO-)=0.2 mol • L﹣1 |
| C.c(CH3COOH)>c(CH3COO- ) | D.c(CH3COO- )+c(OH- )=0.2 mol • L﹣1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
I.下列实验操作或对实验事实的描述中,正确的是________(填序号)。
①用量筒量取稀硫酸溶液8.0 mL;
②Fe(OH)3胶体与FeCl3溶液的混合物可用过滤的方法分离;
③用湿润的pH试纸测量某溶液pH时,测量值可能比真实值小;
④用碱式滴定管量取KMnO4溶液20.50 mL;
⑤在实验室中用锌和稀硫酸反应制氢气,为加快反应速率而不影响H2的品质,可向溶液中加适量Cu(NO3)2晶体。
Ⅱ.将某98%的浓硫酸样品敞口露置于空气中,放置24 h后,取出5 mL浓硫酸与18 mL 9 mol·L-1的NaOH溶液恰好完全中和。请回答下列问题:
(1)该硫酸样品露置24 h后,其物质的量浓度是___________mol·L-1。
(2)若分别用下列方法鉴别浓硫酸和稀硫酸,可以达到目的的是____________(填序号)。
a.常温下加入铜片 b.常温下加入铁片
c.常温下加入木炭 d.用玻璃棒各蘸取少许涂在滤纸上
(3)工业上利用过量氨水吸收硫酸工业尾气中的有害物质,请写出该过程中发生的一个反应的离子方程式_____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列物质的性质与应用对应关系正确的是
A.FeCl3溶液显酸性,可用于蚀刻印刷电路板
B.Na2CO3溶液显碱性,可用于除锅垢中的硫酸钙
C.MgO、Al2O3熔点高,可用于制作耐高温坩埚
D.Na、K合金具有强还原性,可用于原子反应堆的导热剂
查看答案和解析>>
科目:高中化学 来源: 题型:
当Mg(OH)2在水中达到溶解平衡时:Mg(OH)2(s)⇌Mg2+(aq)+2OH﹣(aq)要使Mg(OH)2进一步溶解,应向溶液中加少量的固体是( )
|
| A. | NH4Cl | B. | NaOH | C. | Na2CO3 | D. | Fe |
查看答案和解析>>
科目:高中化学 来源: 题型:
某温度下,相同pH值的盐酸和醋酸溶液分别加水稀释,平衡pH值随溶液体积变化的曲线如图所示.据图判断正确的是( )
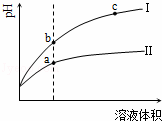
|
| A. | Ⅱ为盐酸稀释时的pH值变化曲线 |
|
| B. | b点溶液的导电性比c点溶液的导电性强 |
|
| C. | a点Kw的数值比c点Kw的数值大 |
|
| D. | b点酸的总浓度大于a点酸的总浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:
根据表提供的数据,判断在等浓度的NaClO、NaHCO3混合溶液中,各种离子浓度关系正确的是( )
| 化学式 | 电离常数 |
| HClO | K=3×10﹣8 |
| H2 CO3 | K1=4.3×10﹣7 |
| K2=5.6×10﹣11 |
|
| A. | c(HCO3﹣)>c(ClO﹣)>c(OH﹣) |
|
| B. | c(ClO﹣)>c(HCO3﹣)>c(H+) |
|
| C. | c(HClO)+c(ClO﹣)=c(HCO3﹣)+c(H2CO3﹣) |
|
| D. | c(Na+)+c(H+)=c(HCO3﹣)+c(ClO﹣)+c(OH﹣) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com