
【题目】如下六个图中,横坐标为某溶液中加入某物质的物质的量,纵坐标为生成沉淀的物质的量,将图中的字母代号填入下表。

溶液 | 加入的物质 | 字母代号 |
①饱和石灰水 | 通过量CO2 | ________ |
②AlCl3溶液 | 通过量NH3 | ________ |
③MgCl2、AlCl3混合溶液 | 逐滴加NaOH溶液至过量 | ________ |
④AlCl3溶液 | 逐滴加NaOH溶液至过量 | ________ |
⑤含少量HCl的AlCl3溶液 | 逐滴加NaOH溶液至过量 | ________ |
【答案】B C A E F
【解析】
试题①饱和石灰水通过量CO2气体,应先有沉淀:Ca(OH)2+CO2=CaCO3↓+H2O,后通入与前一步等量的CO2气体,沉淀溶解CaCO3+CO2+H2O=Ca(HCO3)2,对照图像应为B;②氨水是弱碱,不能溶解氢氧化铝,氯化铝溶液加入过量氨水的反应方程式为:AlCl3+3NH3H2O═Al(OH)3↓+3NH4Cl,对照图像应为C;③MgCl2、AlCl3的混合液,逐滴加入NaOH溶液至过量,先是生成氢氧化镁和氢氧化铝沉淀,MgCl2+2NaOH═Mg(OH)2↓+2NaCl;AlCl3+3NaOH═Al(OH)3↓+3NaCl,后是氢氧化铝溶解,Al(OH)3+NaOH═NaAlO2+2H2O,Mg(OH)2不溶,对照图像应为A.④氯化铝溶液,加入氢氧化钠,氢氧化钠和氯化铝之间反应逐渐产生沉淀直到沉淀量最大,AlCl3+3NaOH═Al(OH)3↓+3NaCl,后是氢氧化铝溶解,Al(OH)3+NaOH═NaAlO2+2H2O,对照图像应为E;⑤含少量HCl的氯化铝溶液,加入氢氧化钠,先是和盐酸之间发生中和反应生成氯化钠和水,没有沉淀,HCl+NaOH=NaCl+H2O,然后氢氧化钠和氯化铝之间反应逐渐产生沉淀直到沉淀量最大,AlCl3+3NaOH═Al(OH)3↓+3NaCl,后是氢氧化铝溶解,Al(OH)3+NaOH═NaAlO2+2H2O,对照图像应为F;故填:B;C;A;E;F;


 科学实验活动册系列答案
科学实验活动册系列答案科目:高中化学 来源: 题型:
【题目】某无色透明的碱性溶液中,能大量共存的离子组是( )
A.Na+、H+、SO42﹣、HCO3﹣
B.Cu2+、K+、SO42﹣、NO3﹣
C.Na+、K+、Cl﹣、NO3﹣
D.Mg2+、K+、SO42﹣、Cl﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电化学在日常生活中用途广泛,图甲是镁-次氯酸钠燃料电池,电池总反应为Mg+ClO-+H2O=Cl-+Mg(OH)2↓,图乙是含Cr2O72-的工业废水的处理。下列说法正确的是

A. 图甲中发生的还原反应是Mg2++ClO-+H2O+2e-=Cl-+Mg(OH)2↓
B. 图乙中Cr2O72-向惰性电极移动,与该极附近的OH-结合,转化成Cr(OH)3除去
C. 图乙电解池中,若有0.84 g阳极材料参与反应,则阴极会有168 mL(标准状况)的气体产生
D. 若图甲燃料电池消耗0.36 g镁产生的电量用以图乙废水处理,理论上可产生1.07g氢氧化铁沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把4molA和2.5molB混合于2L密闭容器中,发生反应:3A(g)+2B(s)![]() xC(g)+D(g),5min后反应达到平衡,容器内压强变小,测得D的平均反应速率为0.05mol·L-1·min-1,错误的是
xC(g)+D(g),5min后反应达到平衡,容器内压强变小,测得D的平均反应速率为0.05mol·L-1·min-1,错误的是
A. A的平均反应速率为0.15mol·L-1·min-1 B. 平衡时,C的浓度为0.25 mol·L-1
C. B的平均反应速率为0.1mol·L-1·min-1 D. 平衡时,容器内压强为原来的0.875倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,a、b、c、d均为石墨电极,通电进行电解,下列说法正确的是( )
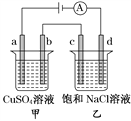
A. 电路中电子流向:负极→d→c→b→a→正极
B. a、c两极产生气体的物质的量相等
C. SO42-向b电极运动,Cl-向c电极运动
D. 通电后乙烧杯滴入酚酞溶液d极会变红
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有A、B、C、D四种化合物,其焰色反应的火焰均为黄色。其中C是一种淡黄色固体,加热固体A可生成D,同时得到能使澄清石灰水变浑浊的无色气体。A与B溶液混合后可得到D。
(1)写出下列物质的化学式:A、_______;B、_______;C、_______;D、_______。
(2)写出A与B反应的离子方程式:_________________________________________。
(3)在甲、乙、丙、丁四个烧杯中各加入100 mL水,再分别加入0.1 mol 的下列物质:①钠、②氧化钠、③过氧化钠、④氢氧化钠,固体完全溶解后,四个烧杯中溶质的质量分数由大到小的顺序是(填编号)___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学兴趣小组用如图所示过程除去AlCl3中含有的Mg2+、K+杂质离子并尽可能减少AlCl3的损失。请回答下列问题:
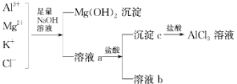
(1)写出混合物中加入足量氢氧化钠溶液时,溶液中发生反应的离子方程式:_______________________。
(2)氢氧化钠溶液能否用氨水代替,为什么?___________________________。
(3)溶液a中存在的离子有________________;在溶液a中加入盐酸时需控制盐酸的量,为什么?__________________________________。为此,改进方法是___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是()
A. 标准状况下,l mol任何物质的体积均为22.4 L
B. CH4的摩尔质量为16 g
C. 1mol H2O的质量为18 gmol-1
D. 1 mol·L-1NaCl溶液的含义是1 L溶液中含有58.5 g NaCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有人设计了如图所示的实验装置来探究钠与水反应(铁架台等仪器已略)。实验前在橡胶塞下端打一个小孔穴,将一大小适中的钠块固定于针头下端,向上抽动针头使钠块藏于孔穴内。在玻璃反应管内装入适量水(使钠块不与水接触)。实验时,拔去橡胶乳头,按住橡胶塞,将针头缓缓向上拔起,使钠与水接触,反应管内的液体被产生的气体压出,流入置于下方的烧杯中,气体则被收集在反应管内。
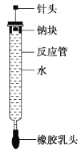
(1)钠与水反应的离子方程式为__________________________________________________。
(2)实验中“钠块熔化为闪亮的小球”说明_____________________;向烧杯中的溶液中滴加____________,溶液变红,说明钠与水反应生成碱性物质。
(3)如果实验前加入反应管内水的体积为a mL,欲使水最终全部被排出,则所取金属钠的质量至少为____________g(设当时实验条件下气体摩尔体积为V mL/mol)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com