
【题目】兴趣小组用莫尔盐[化学式为(NH4)xFe(SO4)2·6H2O(Fe为+2价)]测定KMnO4溶液的物质的量浓度的过程如下:
①称取19.6g莫尔盐配成100mL溶液。
②量取10.00mLKMnO4溶液,向其中加入足量的H2SO4进行酸化,向酸化后的溶液中逐滴滴加莫尔盐溶液,反应完全时消耗莫尔盐溶液的体积20.00mL,所发生反应的离子方程式如下:4H++5Fe2++MnO4-=5Fe3++Mn2++4H2O请回答下列问题:
(1)(NH4)xFe(SO4)2·6H2O中x=___,c(Fe2+)=___。
(2)第①步实验中所需的玻璃仪器除量筒、烧杯、胶头滴管外还有___;
用固体样品配制一定物质的量浓度的溶液,需经过称量、溶解、转移、定容操作。下列图对应的操作规范的是___。
a.称量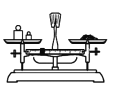 b.溶解
b.溶解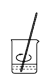 c.转移
c.转移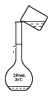 d.定容
d.定容![]()
(3)计算KMnO4溶液的物质的量浓度,写出计算过程。___
【答案】2 0.5mol/L 100mL 容量瓶,玻璃棒 b 0.2mol/L
【解析】
(1)、(NH4)xFe(SO4)2·6H2O中Fe的化合价为+2价,SO42-的化合价为-2价, NH4+的化合价为+1价,根据化合物的化合价的代数和为0,求x的值;根据n [ (NH4)xFe(SO4)2·6H2O] =![]() ,则c (Fe2+) =c [(NH4)xFe(SO4)2·6H2O] =
,则c (Fe2+) =c [(NH4)xFe(SO4)2·6H2O] =![]() ,由此分析解答;
,由此分析解答;
(2)、配制100mL的莫尔盐溶液,所需要的玻璃仪器有量筒、烧杯、胶头滴管、100mL容量瓶、玻璃棒,由此分析解答;
(3)、反应H++ Fe2++ MnO4- →Fe3++Mn2++ H2O中,Fe2+中Fe元素的化合价由+2价升高为+3价,失去1个电子, MnO4-中Mn元素的化合价由+7价降低为-2价,得到5个电子,根据电荷守恒和质量守恒配平方程式为:8H++5 Fe2++ MnO4- =5Fe3++Mn2++ 4H2O,n (Fe2+)=0.5mol/L×20.00×10-3L=0.01mol,根据配平后离子反应,可得关系式: 5Fe2+~ MnO4-,由此结合相关公式分析解答。
(1) 、(NH4)xFe(SO4)2·6H2O中Fe的化合价为+2价,SO42-的化合价为-2价, NH4+的化合价为+1价,根据化合物的化合价的代数和为0可知: (+1) ×x+ (+2)+ (-2) ×2=0,解得x=2;溶液中n [(NH4)xFe(SO4)2·6H2O]=![]() ,则c (Fe2+) =c [(NH4)xFe(SO4)2·6H2O] =
,则c (Fe2+) =c [(NH4)xFe(SO4)2·6H2O] =![]() ,
,
故答案为:2;0.5mol/L;
(2)、配制100mL的莫尔盐溶液,所需要的玻璃仪器有量筒、烧杯、胶头滴管、100mL 容量瓶、玻璃棒;
a、称量时应左物右码,a错误;
b、溶解时搅拌,加速溶解,b正确;
c、转移时应用玻璃棒引流,c错误;
d、定容时,胶头滴管不能深入容量瓶内,d错误;
故答案为:100mL 容量瓶,玻璃棒;b;
(3)\反应H++ Fe2++ MnO4- →Fe3++Mn2++ H2O中,Fe2+中Fe元素的化合价由+2价升高为+3价,失去1个电子, MnO4-中Mn元素的化合价由+7价降低为-2价,得到5个电子,根据电荷守恒和质量守恒配平方程式为:8H++5 Fe2++ MnO4- =5Fe3++Mn2++ 4H2O,n (Fe2+)=0.5mol/L×20.00×10-3L=0.01mol,根据配平后离子反应,可得关系式: 5Fe2+~ MnO4-,n(KMnO4)![]() , c(KMnO4)
, c(KMnO4)![]() ,
,
故答案为:0.2mol/L。


 一课一练课时达标系列答案
一课一练课时达标系列答案科目:高中化学 来源: 题型:
【题目】普伐他汀是一种调节血脂的药物,其结构简式如图所示(未表示出其空间构型)。

下列关于普伐他汀的性质描述正确的是 ( )
A. 能与FeCl3溶液发生显色反应
B. 该物质的分子式为C23H38O7
C. 能发生加成、取代、消去反应,能使酸性KMnO4溶液褪色
D. 1mol该物质最多可与1molNaOH反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有四位同学分别对四种溶液中所含的离子进行检测,结果如下,其中错误的是
A.Ca2+HCO3-Cl-K+B.OH-CO32-Cl-K+
C.Ba2+Na+OH-NO3-D.Cu2+ NO3-OH-Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据了解,铜锈的成分非常复杂,主要成分有Cu2(OH)2CO3和Cu2(OH)3Cl。考古学家将铜锈分为无害锈(形成了保护层)和有害锈(使器物损坏程度逐步加剧,并不断扩散),结构如图所示。
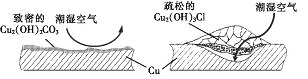
下列说法正确的是
A. Cu2(OH)3Cl属于有害锈
B. Cu2(OH)2CO3属于复盐
C. 青铜器表面刷一层食盐水可以做保护层
D. 用NaOH溶液法除锈可以保护青铜器的艺术价值,做到“修旧如旧”
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组的同学设计实验制备CuBr(白色结晶性粉末,微溶于水,不溶于乙醇等有机溶剂),实验装置(夹持、加热仪器略)如图所示。
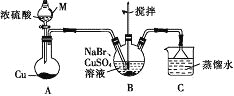
(1)仪器M的名称是________。
(2)若将M中的浓硫酸换成70%的H2SO4,则圆底烧瓶中的固体试剂为______(填化学式)。
(3)B中发生反应的化学方程式为_______,能说明B中反应已完成的依据是_____。若B中Cu2+仍未完全被还原,适宜加入的试剂是_______(填标号)。
a.液溴 b.Na2SO4 c.铁粉 d.Na2S2O3
(4)下列关于过滤的叙述不正确的是_______ (填标号)。
a.漏斗末端颈尖可以不紧靠烧杯壁
b.将滤纸润湿,使其紧贴漏斗内壁
c.滤纸边缘可以高出漏斗口
d.用玻璃棒在漏斗中轻轻搅动以加快过滤速率
(5)洗涤时,先用装置C中的吸收液清洗,其目的是_______,再依次用溶解SO2的乙醇、乙醚洗涤的目的是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过海水晾晒可以得到粗盐,粗盐除还有NaCl外,还含有MgCl2、 CaCl2、 Na2SO4以及泥沙等杂质。以下是某兴趣小组制备精盐的实验方案,各步操作流程如下。下列说法正确的是

A. 实验过程中①、⑤步骤的操作分别是溶解、过滤
B. 实验过程中步骤④的目的是仅除去溶液中的Ca2+
C. 实验过程中步骤⑦中的蒸发所用到的仪器是酒精灯、玻璃棒、烧杯、铁架台(带铁圈)
D. 实验过程中②、④步骤互换,对实验结果不影响
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯和钾与不同价态的铜可生成两种化合物,这两种化合物都可用于催化乙炔聚合,其阴离子均为无限长链结构(如图),已知其中一种化合物的化学式为KCuCl3,下列有关说法中错误的是( )
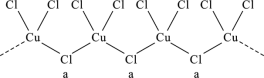
A. a位置上Cl原子的杂化轨道类型为sp3
B. 另一种的化学式为K2CuCl3
C. 铜元素在周期表中位于d区
D. 该物质中存在配位键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下 ①6.72L CH4 ②3.01×1023个HCl分子 ③13.6g H2S ④0.2 mol NH3,这四种气体的关系表达正确的是( )
a.体积②>③>①>④ b.密度②>③>④>①
c.质量②>③>①>④ d.氢原子个数①>③>④>②
A.abcB.bcdC.abdD.abcd
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把1L含有MgSO4和K2SO4的混合溶液分成两等份,一份加入含0.2 molNaOH的溶液,恰好使镁离子完全沉淀为氢氧化镁;另一份加入含0.5molBaCl2的溶液,恰好使硫酸根离子完全沉淀为硫酸钡。则原混合溶液中钾离子的浓度为( )
A.0.3mol·L-1B.1.6mol·L-1
C.0.6mol·L-1D.0.8mol·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com