

| A. | V=40 | |
| B. | c点所示溶液中:c(H+)-c(OH-)=2c(NH3•H2O) | |
| C. | d点所示溶液中:c(NH4+)=2c(SO42-) | |
| D. | NH3•H2O的电离常数K=10-4mol•L-1 |
分析 未加氨水时硫酸溶液中水电离出的c(H+)=10-13 mol/L,则硫酸溶液中c(H+)=$\frac{1{0}^{-14}}{1{0}^{-13}}$mol/L=0.1mol/L,硫酸的浓度是0.05mol/L,
A.c点水电离程度最大,说明此时铵根离子浓度最大,对水的电离促进程度最大;
B.任何电解质溶液中都存在质子守恒;
C.任何电解质溶液中都存在电荷守恒;
D.Kb=$\frac{{K}_{w}}{{K}_{h}}$=$\frac{{K}_{w}}{\frac{c(N{H}_{3}.{H}_{2}O).c({H}^{+})}{c(N{{H}_{4}}^{+})}}$,c点溶液中水电离出的c(H+)=5.6×10-6 mol/L,该溶液中c(NH3.H2O)=c(H+)=5.6×10-6 mol/L,c(NH4+)=2c(SO42- )=0.05mol/L.
解答 解:未加氨水时硫酸溶液中水电离出的c(H+)=10-13 mol/L,则硫酸溶液中c(H+)=$\frac{1{0}^{-14}}{1{0}^{-13}}$mol/L=0.1mol/L,硫酸的浓度是0.05mol/L,
A.c点水电离程度最大,说明此时铵根离子浓度最大,对水的电离促进程度最大,所以两者恰好完全反应生成硫酸铵,而稀硫酸的浓度为0.05mol/L,氨水的浓度是0.1mol/L,所以氨水的体积也是20ml,即V=20,故A错误;
B.c点所示溶液是硫酸铵溶液,溶液中质子守恒:c(H+)=c(NH3.H2O)+c(OH-),所以溶液中存在:c(H+)-c(OH-)=c(NH3.H2O),故B错误;
C.根据电荷守恒:c(H+)+c(NH4+)=2c(SO42-)+c(OH-),而溶液呈中性c(OH-)=c(H+),所以c(NH4+)=2c(SO42-),故C正确;
D.c点溶液中水电离出的c(H+)=5.6×10-6 mol/L,该溶液中c(NH3.H2O)=c(H+)=5.6×10-6 mol/L,c(NH4+)=2c(SO42- )=0.05mol/L,Kb=$\frac{{K}_{w}}{{K}_{h}}$=$\frac{{K}_{w}}{\frac{c(N{H}_{3}.{H}_{2}O).c({H}^{+})}{c(N{{H}_{4}}^{+})}}$=$\frac{1{0}^{-14}}{\frac{5.6×1{0}^{-6}×5.6×1{0}^{-6}}{0.05}}$=1.6×10-5,
故D错误;
故选C.
点评 本题考查酸碱混合溶液定性判断,为高频考点,侧重考查学生分析判断及计算能力,明确图中曲线上各点溶质成分及其性质、电离平衡常数与盐类水解平衡常数关系是解本题关键,易错选项是D.


科目:高中化学 来源: 题型:解答题
 ,YX3的电子式为
,YX3的电子式为 (用元素符号表示).
(用元素符号表示). 查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol•L-1 | B. | 2mol•L-1 | C. | 3mol•L-1 | D. | 4mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题

| A. | 该氢氧化钠溶液的物质的量浓度为0.1 mol/L | |
| B. | 在b点,c (Na+)═c(CH3COO-) | |
| C. | 在d点,溶液中所有离子浓度由大到小的顺序为c (CH3COO-)>c (H+ )>c (Na+)>c (OH-) | |
| D. | 氢氧化钠溶液与醋酸溶液恰好完全反应的点位于曲线b、d间的某点 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 漂白粉露置在空气中:ClO-+CO2+H2O═HClO+HCO3- | |
| B. | 用少量氨水吸收二氧化硫:SO2+NH3•H2O═HSO3-+NH4+ | |
| C. | 少量CO2通入苯酚钠溶液:2C6H5O-+CO2+H2O→2C6H5OH+CO32- | |
| D. | 磁性氧化铁(Fe3O4)溶于氢碘酸:Fe3O4+8H+═Fe2++2Fe3++4H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
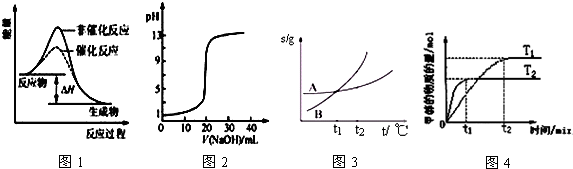
| A. | 图1表示某吸热反应分别在有、无催化剂的情况下反应过程中的能量变化 | |
| B. | 图2表示0.1000 mol•L-1NaOH溶液滴定20.00mL0.1000 mol•L-1CH3COOH溶液所得到的滴定曲线 | |
| C. | 图3表示A、B两物质的溶解度随温度变化情况,将tl℃时A、B的饱和溶液分别升温至t2℃时,溶质的质量分数B=A | |
| D. | 图4表示在其他条件相同时,分别在T1、T2温度下由CO2和H2合成甲醇的物质的量随时间变化情况,则CO2和H2合成甲醇是吸热反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com