
分析 氯气溶于水发生反应Cl2+H2O?H++Cl-+HClO,加人CaCO3固体、NaHCO3固体,导致微粒浓度的变化平衡发生移动,分析次氯酸的浓度变化,由此分析解答.
解答 解:氯气溶于水发生反应Cl2+H2O?H++Cl-+HClO,加人CaCO3固体,因为HCl>H2CO3>HClO>HCO3-,根据强制弱,碳酸钙与生成的盐酸和次氯酸都要反应,所以HClO的浓度减小,而NaHCO3固体只与盐酸反应,氢离子浓度减少,平衡正向移动,次氯酸的浓度变大,故答案为:加人CaCO3固体次氯酸的浓度减小,原因是:次氯酸的酸性强于碳酸氢根离子的酸性,两者反应消耗次氯酸;加人NaHCO3固体次氯酸的浓度增大,原因是:氢离子浓度减少,平衡正向移动,次氯酸的浓度变大.
点评 本题考查氯气的性质,侧重于学生的分析能力和元素化合物知识的综合理解和运用的考查,为高频考点,注意相关基础知识的积累,难道不大.


科目:高中化学 来源: 题型:多选题
| A. | 硫酸工业中二氧化硫的催化氧化,不采用高压是因为压强对SO2转化率无影响 | |
| B. | 同温、同浓度的盐酸和氢氧化钠稀溶液中,水的电离程度相同 | |
| C. | 3C(s)+CaO(s)═CaC2(s)+CO(g)在常温下不能自发进行,说明该反应的△H>0 | |
| D. | 合成氨时,其他条件不变升高温度,反应速率v(H2)和氢气的平衡转化率均增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
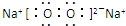 ,AB2所含化学键的类型:离子键、非极性共价键(极性共价键、非极性共价键、离子键).
,AB2所含化学键的类型:离子键、非极性共价键(极性共价键、非极性共价键、离子键).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知H2燃烧热△H为-285.8kJ/mol,则:2H2(g)+O2(g)═2H2O(g)△H=-571.6kJ/mol | |
| B. | 已知稀盐酸与NaOH稀溶液反应的中和热△H为-57.3kJ/mol,则:H2SO4(aq)+2NaOH(aq)═Na2SO4(aq)+2H2O(l)△H=-57.3kJ/mol | |
| C. | 电解稀硫酸可能发生反应:Cu+H2SO4$\frac{\underline{\;电解\;}}{\;}$CuSO4+H2↑ | |
| D. | 以石墨为电极电解MgCl2溶液的总离子方程式:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$H2↑+Cl2↑+2OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Z2+能促进水的电离 | |
| B. | 常见单质的熔点:X>Z>Y | |
| C. | 若元素R的某种微粒R2-,则R不一定与Y同主族 | |
| D. | Y与W组成的二元化合物是制耐高温坩埚的常用材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下.11.2LNH3中含有N一H键的数目为1.5N | |
| B. | 足量的铜与含2mo1H2SO4的浓硫酸充分反应.可生成NA个SO2分子 | |
| C. | 标准状况下.将11.2LC12通人足量的石灰乳中制备漂白粉.转移的电子数为0.5NA | |
| D. | 常温常压下.21g氧气和27g臭氧所含的氧原子总数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | V=40 | |
| B. | c点所示溶液中:c(H+)-c(OH-)=2c(NH3•H2O) | |
| C. | d点所示溶液中:c(NH4+)=2c(SO42-) | |
| D. | NH3•H2O的电离常数K=10-4mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铜为阳极、铜为阴极,电解液为CuSO4溶液 | |
| B. | 石墨为阳极、铁为阴极,电解液为CuSO4溶液 | |
| C. | 铁为阳极,铜为阴极,电解液为AgNO3溶液 | |
| D. | 石墨为阳极,铁为阴极,电解液为NaCl溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 工业上常用电解法制备元素C、D、E的单质 | |
| B. | 一定条件下,元素C、D的最高价氧化物对应的水化物之间不能发生反应 | |
| C. | 化合物AE与CE具有相同类型的化学键 | |
| D. | 元素A、B组成的化合物常温下一定呈气态 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com