
 工业废水随意排放会造成严重污染,根据成分不同可采用不同的处理方法.
工业废水随意排放会造成严重污染,根据成分不同可采用不同的处理方法.分析 (1)①沉淀转移的方向是向着更难溶的方向移动,通过Ksp的大小可知那种物质更加难溶;
②亚硫酸钡溶于盐酸,不溶于碱性溶液,硝酸可以把亚硫酸根氧化为硫酸根,而硫酸钡既不溶于水也不溶于酸;
③已知元素在高价态时常表现氧化性,若在酸性CuSO4溶液中加入一定量的Na2SO3和NaCl溶液,加热,生成CuCl沉淀,则生成CuCl的离子方程式为:2Cu2++SO32-+2Cl-+H2O$\frac{\underline{\;\;△\;\;}}{\;}$2CuCl↓+SO42-+2H+;
(2)A.Fe板作阳极,为活性电极,Fe失电子,发生氧化反应生成亚铁离子;
B.由反应式Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O可知,处理过程中消耗氢离子;
C.阴极发生还原反应,溶液中的氢离子得到电子减少,同时生成氢氧根;
D.Fe-2e-=Fe2+,则转移电子数12mol需要6molFe,再根据能够处理的关系式,得6Fe~12e-~6Fe2+~Cr2O72-,据此计算;
(3)氨气作燃料应充入负极区,碱性燃料电池氢氧根离子常参与电极反应,氨气中的N失去电子化合价升高,说明X对大气无污染,因此X为氮气.
解答 解:(1)①由于Ksp(FeS)>Ksp(CuS),所以在相同条件下CuS的溶解度更小,沉淀会向着生成CuS的方向进行,故离子方程式为FeS(s)+Cu2+(aq)=CuS(s)+Fe2+(aq),故答案为:①FeS(s)+Cu2+(aq)=CuS(s)+Fe2+(aq);
②A、Ba(NO3)2 中有硝酸根离子,二氧化硫通入后生成亚硫酸,亚硫酸电离出氢离子,就相当于硝酸了.硝酸氧化亚硫酸成硫酸,硫酸根离子和钡离子结合生成硫酸钡沉淀,故可选;
B、因为亚硫酸钡溶于盐酸,较弱酸不能制备较强酸,所以不能生成沉淀,故不可选;
C、二氧化硫和氢氧根反应生成亚硫酸根离子,钡离子和亚硫酸根离子结合生成亚硫酸钡沉淀,故可选;
D、与B项相比,溶有氨气的BaCl2溶液呈碱性,在碱性溶液中可以生成亚硫酸钡沉淀,故可选;
故答案为:ACD;
③已知元素在高价态时常表现氧化性,若在酸性CuSO4溶液中加入一定量的Na2SO3和NaCl溶液,加热,生成CuCl沉淀,则生成CuCl的离子方程式为:2Cu2++SO32-+2Cl-+H2O$\frac{\underline{\;\;△\;\;}}{\;}$2CuCl↓+SO42-+2H+,故答案为:2Cu2++SO32-+2Cl-+H2O$\frac{\underline{\;\;△\;\;}}{\;}$2CuCl↓+SO42-+2H+;
(2)A.Fe板作阳极,为活性电极,Fe失电子,发生氧化反应生成亚铁离子,阳极反应为Fe-2e-═Fe2+,故A正确;
B.由反应式Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O可知,处理过程中消耗氢离子,溶液的酸性减弱,溶液pH增大,故B错误;
C.阴极发生还原反应,溶液中的氢离子得到电子减少,同时生成氢氧根,有Fe(OH)3沉淀生成,故C正确;
D.Fe-2e-=Fe2+,则转移电子数12mol需要6molFe,再根据能够处理的关系式,得6Fe~12e-~6Fe2+~Cr2O72-,故被还原的Cr2O72-的物质的量为1mol,故D错误;
故选BD;
(3)在燃料电池中,可燃物充入负极区,所以NH3充入的a极作负极;产生的X气体为氧化产物,可直接排放到大气中,说明X对大气无污染,因此X为氮气,由该燃料电池示意图可知负极反应产物有水,由于是碱性电池,氢氧根离子也参与负极电极反应,综上所述可写出负极反应式:2NH3+6OH--6e-=N2+6H2O;故答案为:负;2NH3+6OH--6e-=N2+6H2O.
点评 本题考查电解原理、氧化还原反应等,清楚发生的电极反应是解题的关键,是对学生综合能力的考查,难度中等.


 轻松暑假总复习系列答案
轻松暑假总复习系列答案科目:高中化学 来源: 题型:选择题
| A. |  2,2,4-三甲基一4 一戊烯 2,2,4-三甲基一4 一戊烯 | B. | 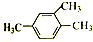 l,3,4一三甲苯 l,3,4一三甲苯 | ||
| C. | 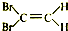 反-1,2-二溴乙烯 反-1,2-二溴乙烯 | D. | 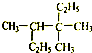 3,3,4-三甲基己烷 3,3,4-三甲基己烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 节日绽放的焰火运用到“焰色反应”原理 | |
| B. | 处理废水时加入明矾作为消毒剂可以除去水中的细菌 | |
| C. | 纯碱可用作制药工业的原料,用于治疗胃酸过多 | |
| D. | 含磷合成洗涤剂易于被细菌分解,故不会导致水体污染 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ②③ | C. | ①③④ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度/℃ | 25 | t 1 | t 2 |
| 水的离子积 KW | 1×10-14 | 1×10-13 | 1×10-12 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将少量过氧化钠放入水中:Na2O2+H2O═2Na++2OH-+O2↑ | |
| B. | 硫酸溶液与氢氧化钡溶液反应:Ba2++SO42-═BaSO4↓ | |
| C. | 氯气与水反应:Cl2+H2O═Cl-+2H++ClO- | |
| D. | 硅酸钠溶液中通入过量CO2:SiO32-+2CO2+2H2O═H2SiO3↓+2HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 固体Cu(OH)2和H2SO4溶液反应 | B. | 澄清石灰水和HNO3 溶液反应 | ||
| C. | KOH 溶液和醋酸溶液反应 | D. | Ba(OH)2溶液和H2SO4溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 加热浓氨水 | B. | 加热NH4Cl固体 | ||
| C. | 加热NH4Cl和Ca(OH)2的混合物 | D. | 加热小苏打固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 糖类的分子通式为 Cm(H2O)n | B. | 糖类物质都有甜味 | ||
| C. | 蔗糖不是淀粉水解的产物 | D. | 糖类一般都能水解反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com