
| ʵ�� | �¶�/�� | ��ʼʱ | ƽ��ʱ | |||
| n��CO��/mol | n��H2S��/mol | n��COS��/mol | n��H2��/mol | n��CO��/mol | ||
| 1 | 150 | 10.0 | 10.0 | 0 | 0 | 7.0 |
| 2 | 150 | 7.0 | 8.0 | 2.0 | 4.5 | a |
| 3 | 400 | 20.0 | 20.0 | 0 | 0 | 16.0 |
| A�� | ������Ӧ�����ȷ�Ӧ | |
| B�� | ʵ��1 ��ƽ��ʱ��CO ��ת����Ϊ70% | |
| C�� | ʵ��2 ��ƽ��ʱ��a��7.0 | |
| D�� | ʵ��3 ��ƽ����ٳ���1.0molH2��K ֵ����ƽ�������ƶ� |
���� A�����������Ϊ1L��
ʵ��1 CO��g��+H2S��g��?COS��g��+H2��g����
��ʼ��mol/L��10.0 10.0 0 0
��Ӧ��mol/L��3.0 3.0 3.0 3.0
ƽ�⣨mol/L��7.0 7.0 3.0 3.0
��ѧƽ�ⳣ��=$\frac{3.0��3.0}{7.0��7.0}$=$\frac{9}{49}$��
ʵ��3 CO��g��+H2S��g��?COS��g��+H2��g����
��ʼ��mol/L��20.0 20.0 0 0
��Ӧ��mol/L��4.0 4.0 4.0 4.0
ƽ�⣨mol/L��16.0 16.0 4.0 4.0
��ѧƽ�ⳣ��=$\frac{4��4}{16��16}$=$\frac{1}{16}$��
�����¶Ȼ�ѧƽ�������ȷ����ƶ���
B��ʵ��1 ��ƽ��ʱ��CO ��ת����=$\frac{��Ӧ��n��CO��}{��Ӧ��ʼn��CO��}$��100%��
C������Qc��K֮��Ĵ�С���жϷ�Ӧ���еķ���
D����ѧƽ�ⳣ��ֻ���¶��йأ��¶Ȳ��仯ѧƽ�ⳣ�����䣮
��� �⣺A�����������Ϊ1L��
ʵ��1 CO��g��+H2S��g��?COS��g��+H2��g����
��ʼ��mol/L��10.0 10.0 0 0
��Ӧ��mol/L��3.0 3.0 3.0 3.0
ƽ�⣨mol/L��7.0 7.0 3.0 3.0
��ѧƽ�ⳣ��=$\frac{3.0��3.0}{7.0��7.0}$=$\frac{9}{49}$=0.18��
ʵ��3 CO��g��+H2S��g��?COS��g��+H2��g����
��ʼ��mol/L��20.0 20.0 0 0
��Ӧ��mol/L��4.0 4.0 4.0 4.0
ƽ�⣨mol/L��16.0 16.0 4.0 4.0
��ѧƽ�ⳣ��=$\frac{4��4}{16��16}$=$\frac{1}{16}$=0.0625��0.18��
�����¶Ȼ�ѧƽ�������ȷ����ƶ���ͨ�����Ϸ���֪�������¶Ȼ�ѧƽ�ⳣ����С��������Ӧ�Ƿ��ȷ�Ӧ����A����
B��ʵ��1 ��ƽ��ʱ��CO ��ת����=$\frac{��Ӧ��n��CO��}{��Ӧ��ʼn��CO��}$��100%=$\frac{10.0mol-7.0mol}{10.0mol}$��100%=30%����B����
C��150�棬=$\frac{3.0��3.0}{7.0��7.0}$=$\frac{9}{49}$����Qc=$\frac{2��4.5}{7��8}$=$\frac{9}{56}$����Qc��K����Ӧ������Ӧ�����ƶ�������ʵ��2��ƽ��ʱ��a��7.0����C��ȷ��
D����ѧƽ�ⳣ��ֻ���¶��йأ��¶Ȳ��仯ѧƽ�ⳣ�����䣬ʵ��3 ��ƽ����ٳ���1.0molH2��K ֵ���䣬ƽ�������ƶ�����D����
��ѡC��
���� ���⿼���˻�ѧƽ�ⳣ��������ͼ���Ӧ�ã�ת���ʵķ����жϣ�����ƽ�ⳣ���ļ�����жϷ�����ƽ���ƶ�ԭ���ǽ���ؼ�����Ŀ�Ѷ��еȣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
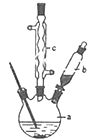 ������ͭ�Ǻϳ��������������в���--��������ͭ����Ҫǰ����֮һ������������һ��ʵ���Һϳ�·�ߣ�
������ͭ�Ǻϳ��������������в���--��������ͭ����Ҫǰ����֮һ������������һ��ʵ���Һϳ�·�ߣ�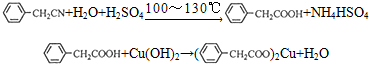
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��ƶ���
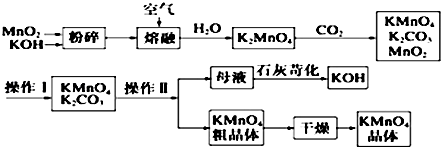
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��ѧ��Ӧ��Ȼ�����������ı仯 | |
| B�� | ����ת����;����ͬʱ����ϵ��������������ͬ | |
| C�� | ���ȷ�Ӧָ����������������ڷ�Ӧ��������� | |
| D�� | ���ȷ�Ӧ�����ȾͲ��ᷢ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
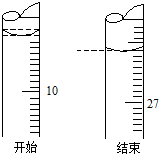 ijѧ��������֪���ʵ���Ũ�ȵ�����ⶨδ֪���ʵ���Ũ�ȵ�����������Һʱ��ѡ���̪��ָʾ��������д���пհף�
ijѧ��������֪���ʵ���Ũ�ȵ�����ⶨδ֪���ʵ���Ũ�ȵ�����������Һʱ��ѡ���̪��ָʾ��������д���пհף��鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| ʱ�� | ��ʼ | 8Сʱ | 16Сʱ | 24Сʱ | 32Сʱ | 40Сʱ | 48Сʱ |
| pH | 5.0 | 4.8 | 4.5 | 4.3 | 4.2 | 4.0 | 4.0 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ����Ӧ�Ƿ��ȷ�Ӧ�Ŀ��淴Ӧ�������¶�v��������v���棩 | |
| B�� | �����¶Ȼ�ʹ�ô�����ͨ�����ӻ���Ӱٷ�����ʹ��Ӧ���ʼӿ� | |
| C�� | ��������ԭ��ֻʹ���ڿ��淴Ӧ����ʹ�����ܽ��������ʵĵ��� | |
| D�� | ��G=��H-T��S�ʺ����������Ļ�ѧ��Ӧ���еķ����о� |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com