
【题目】近期,美国某研究小组在《Nature Energy》报道了一种 CO2 电解装置,膜界面处的离子通过中间通道重组直接制备高纯 HCOOH 溶液,其工作原理如图。下列说法正确的是

A.a 电极连接直流电源的正极
B.该电解池工作原理2CO2+2H2O![]() 2HCOOH+O2
2HCOOH+O2
C.M、N 分别是阴离子交换膜、阳离子交换膜
D.电路中转移 1mole- 时,阳极产生 5.6LO2
【答案】BC
【解析】
A.由题中图示可知,a电极发生还原过程,得电子被还原,为阴极,则a电极与电源负极相连,故A错误;
B.由题中图示可知,a电极发生还原过程,得电子被还原,为阴极,b电极发生氧化过程,失电子被氧化,为阳极,则阴极CO2在酸性环境下得电子,电极反应为2CO2+4e-+4H+=2HCOOH,阳极H2SO4溶液中氢氧根失电子,由于是强酸性环境下,则电极反应为2H2O-4e-=O2+4H+,该电解池工作原理2CO2+2H2O![]() 2HCOOH+O2,故B正确;
2HCOOH+O2,故B正确;
C.根据a电极为阴极,由电极反应可知,阴极区附近消耗了氢离子,使阴离子浓度增大,b电极为阳极,由电极反应可知,阳极区附近产生了氢离子,使阳离子浓度增大,电解池中阳离子向阴极区移动,阴离子向阳极区移动,可判断M为阴离子交换膜,N为阳离子交换膜,故C正确;
D.由阳极b的电极反应2H2O-4e-=O2+4H+可知,转移4mole-,产生1molO2,则转移1mole-,产生0.25molO2,由于没有注明是标准状况,不能用气体摩尔体积Vm=22.4L/mol计算,不能得出O2的体积,故D错误;
答案为BC。


 中考解读考点精练系列答案
中考解读考点精练系列答案 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案科目:高中化学 来源: 题型:
【题目】充分燃烧一定量丁烷(C4H10),生成CO2和液态水,放出热量x kJ,将此CO2完全吸收生成正盐,需5mol/L的KOH溶液100mL,则丁烷的燃烧热为( )
A.16x kJ·mol﹣1B.8x kJ·mol﹣1C.4x kJ·mol﹣1D.2x kJ·mol﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】火药制备是我国古代闻名世界的化学工艺,原理为 2KNO3+S+3C=K2S+N2↑+ 3CO2 ↑。下列表示反应中相关微粒的化学用语正确的是
A.K+的结构示意图: B.K2S 的电子式:
B.K2S 的电子式:![]()
C.CO2 的结构式为:O=C=OD.16O2与 18O3 互为同位素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下,由一氧化碳和二氧化碳组成的混合气体为6.72 L,质量为12g,此混合物中一氧化碳和二氧化碳物质的量之比是__________,一氧化碳的体积分数是__________,一氧化碳的质量分数是__________,碳原子和氧原子个数比是__________,混合气体的平均相对分子质量是__________,密度是__________g·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)0.3 mol NH3分子中所含原子数与________个H2O分子中所含原子数相等。
(2)含有0.4 mol Al3+的Al2(SO4)3溶液中所含SO42-的物质的量是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关热化学方程式书写与对应表述均正确的是( )
A. 稀硫酸与0.1 mol/L NaOH溶液反应:H+(aq)+OH-(aq)= H2O(l)△H = +57.3 kJ·mol-1
B. 在101KPa下氢气的燃烧热△H =-285.5 kJ·mol-1,则水分解的热化学方程式:2H2O(l)=2H2(g)+O2(g) △H = +285.5 kJ·mol-1
C. 已知2C(s)+O2(g)=2CO(g) △H=-221 kJ·mol-1, 则可知C的燃烧热大于110.5 kJ·mol-1
D. 2N2O5(g)![]() 4NO2(g)+O2(g) ΔH>0 反应为熵增反应,任何温度下能自发进行
4NO2(g)+O2(g) ΔH>0 反应为熵增反应,任何温度下能自发进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SO2是有用的化工原料,回收利用SO2既能减少大气污染,又能充分利用资源。有学者提出利用Fe3+、Fe2+等离子的作用,在常温下将SO2氧化成SO42-而实现SO2的回收利用。某研究性学习小组设计如下方案,在实验室条件下测定转化器的脱硫效率:
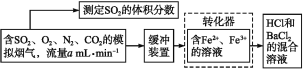
(1)写出Fe3+将SO2反应的离子方程式:__。
(2)若上述实验是在标准状况下进行的,欲测定转化器中的脱硫效率,现已测得气体流量和模拟烟气中SO2的体积分数,还需要测定的数据是___。
(3)向滴有紫色石蕊溶液的试管中通入SO2气体,现象是__;若再向其中滴入足量的氯水,现象是__,涉及反应的化学方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨技术的创立开辟了人工固氮的重要途径,其研究来自正确的理论指导,合成氨反应的平衡常数K值和温度的关系如表:
温 度(℃) | 360 | 440 | 520 |
K值 | 0.036 | 0.010 | 0.0038 |
(1)①由上表数据可知该反应为_____ (填放热,吸热,无法确定 )反应。
②下列措施能用勒夏特列原理解释是_____(填序号)。
a.增大压强有利于合成氨 b.使用合适的催化剂有利于快速生成氨
c.生产中需要升高温度至500°C左右 d.需要使用过量的N2,提高H2转化率
(2)0.2mol氨气溶于水后再与含有0.2mol硫酸的溶液反应放热QkJ,请你用热化学方程式表示其反应式_____。
(3)常温时,将amol氨气溶于水后,再通入bmol氯化氢,溶液体积为1L,且c(NH4+)=c(Cl﹣),则一水合氨的电离平衡常数Kb=_____(用ab表示)。
(4)原料气H2可通过反应 CH4(g)+H2O (g)![]() CO(g)+3H2(g) 获取,已知该反应中,当初始混合气中的
CO(g)+3H2(g) 获取,已知该反应中,当初始混合气中的![]() 恒定时,温度、压强对平衡混合气CH4含量的影响如图所示:
恒定时,温度、压强对平衡混合气CH4含量的影响如图所示:
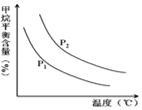
①图中,两条曲线表示压强的关系是:P1_____P2(填“>”、“=”或“<”)。
②其它条件一定,升高温度,氢气的产率会__(填“增大”,“减小”减小,“不变”不变)。
(5)原料气H2还可通过反应CO(g)+H2O(g)![]() CO2(g)+H2(g)获取。
CO2(g)+H2(g)获取。
①T℃时,向容积固定为5L的容器中充入1mol水蒸气和1mol CO,反应达平衡后,测得CO的浓度为0.08molL﹣1,该温度下反应的平衡常数K值为_____。
②保持温度仍为T℃,容积体积为5L,改变水蒸气和CO的初始物质的量之比,充入容器进行反应,下列描述能够说明体系处于平衡状态的是_____(填序号)。
a.容器内压强不随时间改变
b.混合气体的密度不随时间改变
c.单位时间内生成a mol CO2的同时消耗a mol H2
d.混合气中n(CO):n(H2O):n(CO2):n(H2)=1:16:6:6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液可能含有Al3+、NH4+、Fe2+、Na+、CO32-、SO42-、Cl-、NO3-中的若干种,若在该溶液中逐滴加入稀盐酸至过量,无明显现象,并得到X溶液,对X溶液进行如下实验,下列结论正确的是( )(忽略水的电离,且原溶液中各离子浓度均为0.5mol/L)
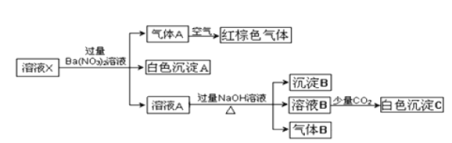
A.原溶液中一定存在NH4+、Fe2+、SO42-B.原溶液中可能合有NO3-和Al3+
C.白色沉淀C可能是![]() D.沉淀B可能是Fe(OH)2和Fe(OH)3的混合物
D.沉淀B可能是Fe(OH)2和Fe(OH)3的混合物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com