
【题目】A是石油裂解气的主要成分,它的产量通常用来衡量一个国家的石油化工发展水平。以A原料衍生出部分化工产品的反应流程如下(部分反应条件已略去):

已知:①2RCHO+O2![]() 2RCOOH;
2RCOOH;
②R-CH=CH-OH烯醇式的结构不能稳定存在。
请回答下列问题:
(1)A的电子式为______。
(2)B、D分子中的官能团名称分别是______、______。
(3)C和B反应生成D的化学方程式为___________,该反应的类型为_____________。
(4)E的结构简式为_________。
(5)结合题意,写出E可能的同分异构体的结构简式__________。
(6)F和C反应生成G的化学方程式为_________。
【答案】![]() 羟基酯基CH3COOH+CH3CH2OH
羟基酯基CH3COOH+CH3CH2OH![]() CH3COOCH2CH3+H2O酯化反应
CH3COOCH2CH3+H2O酯化反应![]() CH3CHO2CH3COOH+HOCH2CH2OH
CH3CHO2CH3COOH+HOCH2CH2OH![]() CH3COOCH2CH2OOCCH3+2H2O
CH3COOCH2CH2OOCCH3+2H2O
【解析】
A是石油裂解气的主要成分,它的产量通常用来衡量一个国家的石油化工发展水平,A是乙烯。乙烯与水发生加成反应生成B是乙醇,B氧化生成C是乙酸,乙酸和乙醇发生酯化反应生成D是乙酸乙酯。F与C反应生成G,根据G、F的分子式可判断该反应酯化反应,所以F是乙二醇,G的结构简式为CH3COOCH2CH2OOCCH3。E与水反应生成F,由于烯醇式的结构不能稳定存在,所以E的结构简式为![]() ,据此解答。
,据此解答。
根据以上分析可知A是CH2=CH2,B是CH3CH2OH,C是CH3COOH,D是CH3COOCH2CH3,E是![]() ,F是HOCH2CH2OH,G是CH3COOCH2CH2OOCCH3。则
,F是HOCH2CH2OH,G是CH3COOCH2CH2OOCCH3。则
(1)乙烯的电子式为![]() 。
。
(2)B是CH3CH2OH,D是CH3COOCH2CH3,分子中的官能团名称分别是羟基、酯基。
(3)根据以上分析可知C和B反应生成D的化学方程式为CH3COOH+CH3CH2OH![]() CH3COOCH2CH3+H2O,该反应的类型为酯化反应或取代反应。
CH3COOCH2CH3+H2O,该反应的类型为酯化反应或取代反应。
(4)根据以上分析可知E的结构简式为![]() 。
。
(5)分子式相同结构不同的化合物互为同分异构体,则E可能的同分异构体的结构简式为CH3CHO。
(6)根据以上分析可知F和C反应生成G的化学方程式为2CH3COOH+HOCH2CH2OH![]() CH3COOCH2CH2OOCCH3+2H2O。
CH3COOCH2CH2OOCCH3+2H2O。


科目:高中化学 来源: 题型:
【题目】可逆反应2SO2(g)+O2(g)![]() 2SO3(g) △H<0一定条件下在某密闭容器中达到平衡。t1时改变某一条件,反应速率与时间关系如下图。下列说法中正确的是( )
2SO3(g) △H<0一定条件下在某密闭容器中达到平衡。t1时改变某一条件,反应速率与时间关系如下图。下列说法中正确的是( )
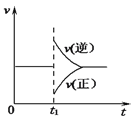
A. 维持温度、反应体系体积不变,t1时充入SO3(g)
B. 维持压强不变,t1时升高反应体系温度
C. 维持温度不变,t1时扩大反应体系体积
D. 维持温度、容器体积不变,t1时充入SO3(g),同时减少SO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向KBr和KI的混合溶液中通入足量的氯气后,溶液蒸干后并将剩余物灼烧,最后残余的物质是( )
A.KCl
B.KCl和I2
C.KCl和Br2
D.KCl和KBr
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】莽草酸是一种合成治疗禽流感药物达菲的原料,鞣酸存在于苹果、生石榴等植物中。下列关于这两种有机化合物的说法正确的是( )

A. 莽草酸的分子式为C7H12O5
B. 两种酸均能与溴的CCl4发生加成反应
C. 鞣酸分子与莽草酸分子相比多了两个碳碳双键
D. 等物质的量的两种酸与足量金属钠反应产生氢气的量相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,用 Fe2O3、 NiO 或 Cr2O3作催化剂对燃煤烟气进行回收,使 SO2转化生成为 S。催化剂不同,相同其他条件(浓度、温度、压强)情况下, 相同时间内 SO2 的转化率随反应温度的变化如下图:下列说法不正确的是( )
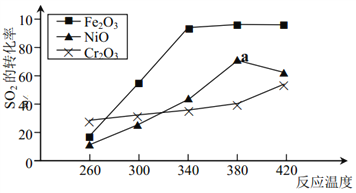
A. 不考虑催化剂价格因素,选择 Fe2O3 作催化剂可以节约能源
B. 相同其他条件下,选择 Cr2O3 作催化剂, SO2 的平衡转化率最小
C. a 点后 SO2 的转化率减小的原因可能是温度升高催化剂活性降低了
D. 选择 Fe2O3 作催化剂,最适宜温度为 340~380℃温度范围
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(一)乙炔是一种重要的化工原料,最新研制出的由裂解气(H2、CH4、C2H4)与煤粉在催化剂条件下制乙炔,该生产过程是目前清洁高效的煤化工过程。已知:发生的部分反应如下(在25℃、 101 kPa时),CH4、C2H4 在高温条件还会分解生成炭与氢气:
①C (s) +2H2(g)![]() CH4(g) △H1=-74.85kJmol-1
CH4(g) △H1=-74.85kJmol-1
②2CH4(g)![]() C2H4(g) +2H2(g) △H2=340.93kJmol-1
C2H4(g) +2H2(g) △H2=340.93kJmol-1
③C2H4(g)![]() C2H2(g) +H2(g) △H3=35.50kJmol-1
C2H2(g) +H2(g) △H3=35.50kJmol-1
请回答:
(1)依据上述反应, 请写出 C 与 H2化合生成 C2H2 的热化学方程式:______________。
(2)若以乙烯和氢气的混合气体以一定流速通过填充有催化剂的反应器(氢气的作用是活化催化剂),出口气中含有乙烯、乙炔、氢气等。图1 为乙炔产率与进料气中 n(氢气)/n(乙烯)的关系。图中曲线呈现先升高后降低的变化趋势,其降低的原因是______________。
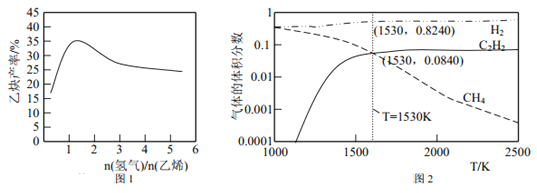
(3)图 2 为上述诸反应达到平衡时各气体体积分数和反应温度的关系曲线。
①乙炔体积分数在1530℃之前随温度升高而增大的原因可能是_______________;1530℃之后,乙炔体积分数增加不明显的主要原因可能是_______________。
②在体积为1L的密闭容器中反应,1530℃时测得气体的总物质的量为1.000 mol,则反应C2H4(g)![]() C2H2(g) +H2(g) 的平衡常数 K=_______________。
C2H2(g) +H2(g) 的平衡常数 K=_______________。
③请在图3中绘制乙烯的体积分数和反应温度的关系曲线__________。
(二)当今,人们正在研究有机锂电解质体系的锂-空气电池,它是一种环境友好的蓄电池。放电时电池的总反应为:4Li+O2===2Li2O。在充电时,阳极区发生的过程比较复杂,目前普遍认可的是按两步进行,请补充完整。电极反应式: ________________________和 Li2O2-2e-=2Li++O2。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知NO2与N2O4可相互转化:2NO2(g)![]() N2O4(g) ΔH=-24.2 kJ·mol-1,在恒温下,将一定量NO2和N2O4(g)的混合气体充入体积为2 L的密闭容器中,其中物质的量浓度随时间变化的关系如下图所示。下列推理分析不合理的是( )
N2O4(g) ΔH=-24.2 kJ·mol-1,在恒温下,将一定量NO2和N2O4(g)的混合气体充入体积为2 L的密闭容器中,其中物质的量浓度随时间变化的关系如下图所示。下列推理分析不合理的是( )

A. 前10 min内,用v(NO2)表示的反应速率为0.04 mol·L-1·min-1
B. 反应进行到10 min时,体系放出的热量为9.68 kJ
C. a点正反应速率小于逆反应速率
D. 25 min时,正反应速率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以N2和H2为反应物,盐酸酸化的NH4Cl溶液为电解质的原电池,工作原理如下图所示,下列说法不正确的是
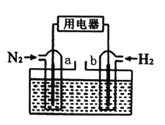
A. b电极为负极
B. 反应过程中,溶液中的Cl-向a电极移动
C. a电极的电极反应式为:N2+6e-+8H+=2NH4+
D. 电池反应为N2+3H2+2HCl=2NH4Cl
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com