
【题目】以N2和H2为反应物,盐酸酸化的NH4Cl溶液为电解质的原电池,工作原理如下图所示,下列说法不正确的是
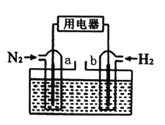
A. b电极为负极
B. 反应过程中,溶液中的Cl-向a电极移动
C. a电极的电极反应式为:N2+6e-+8H+=2NH4+
D. 电池反应为N2+3H2+2HCl=2NH4Cl
科目:高中化学 来源: 题型:
【题目】对物质进行分类是中学生必须要学会的方法。下列各物质在分类上正确的是
A. 白磷、白糖、白糕属于单质 B. 纯碱、烧碱、泡花碱属于碱
C. 盐酸、硝酸、磷酸属于强酸 D. KCl、FeSO4、NaHSO4属于盐
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】周环反应是一类同时成键与断键的反应,经典的周环反应有Diels-Alder反应![]() 、电环化反应(electrocyclicreaction):
、电环化反应(electrocyclicreaction): ![]() 等。
等。
已知:  ,其中R1、R2、R3为烷基。
,其中R1、R2、R3为烷基。
现有一种内酯I(含两个五元环)的合成路线如下(A~I均表示一种有机化合物):

回答下列问题:
(1)化合物A中含有的官能团名称是_______,D的分子式为_______。
(2)由C生成D的反应类型为_______,A形成高聚物的结构简式为_______。
(3)写出F与足量银氨溶液反应的化学方程式_______ 。
(4)化合物H的系统命名为_______ 。
(5)化合物I的质谱表明其相对分子质量为142,I的核磁共振氢谱显示为2组峰,I的结构简式为_______ 。
(6)在化合物I的同分异构体中能同时符合下列条件的是_______ (填写结构简式)。
①具有酚结构;②仅有一种官能团;③具有4种氢原子
(7)2,5-二甲基四氢呋喃(![]() )是新的液态代用燃料,其具有比能量高、沸点高、可再生等优点。该有机物可由A先与H2发生加成反应等一系列步骤来制备,请写出合成路线______(其它试剂任选)。
)是新的液态代用燃料,其具有比能量高、沸点高、可再生等优点。该有机物可由A先与H2发生加成反应等一系列步骤来制备,请写出合成路线______(其它试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】位于前四周期的8种元素A、B、C、D、E、F、G、H的原子序数依次增大,其中A是所有原子中原子半径最小的,且与B同族,C的基态原子2P能级上只有1个电子,F可与A可按原子个数比1∶1和1∶2形成化合物;F与G同族,H的原子序数为29,根据上述信息描述,请回答下列问题:
(1)请写出上述8种元素中电负性最大的元素与B元素形成常见的化合物的化学式_______(用具体元素符号表示的化学式),写出基态原子的第一电离能最大的元素在周期表中的位置为________。
(2)写出H的原子在基态时的核外电子排布式为____________。
(3)1mol D2A6分子(链状)中含有![]() 键的数目为____________。
键的数目为____________。
(4)已知A2F2分子结构如图a所示,则其中心原子杂化轨道类型为_________。

(5)判断A2F2________(填难或易)溶于DG2,并简要说明原因___________。
(6)C与E形成某化合物的晶胞如图 b所示,则处于晶胞顶角上的原子的配位数为________,若该化合物的密度为![]() g·cm
g·cm![]() ,阿伏加德罗常数为NA,则两个最近E原子间的距离为_______ pm(用含
,阿伏加德罗常数为NA,则两个最近E原子间的距离为_______ pm(用含![]() 、NA的代数式表示)。
、NA的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质能相互反应得到氢氧化铝沉淀的是
A. 金属铝和氢氧化钠溶液 B. 硝酸铝溶液和过量氢氧化钠溶液
C. 氧化铝和热水 D. 硫酸铝溶液和过量的氨水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示的原电池装置,X、Y 为两电极,电解质溶液为稀硫酸,外电路中的电子流向如图,对此装置的下列说法正确的是( ) 
A.外电路的电流方向为:X→外电路→Y
B.若两电极分别为 Zn 和碳棒,则 X 为碳棒,Y 为 Zn
C.若两电极都是金属,则它们的活动性为 X>Y
D.X 极上发生的是还原反应,Y 极上发生的是氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. MgO(s)+C(s)=Mg(s)+CO(g)在室温下不能自发进行,说明该反应的△H<0
B. 0.1mol/L的CH3COONa溶液加水稀释后,溶液中![]() 的值减小
的值减小
C. 常温常压下,4.4gCO2与足量Na2O2完全反应生成O2分子数为6.02×1022个
D. 用pH均为2的盐酸和甲酸中和等物质的量的NaOH溶液,盐酸消耗的体积多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验兴趣小组用如下两种方法制取氮气。

已知:活性炭可用于吸附水中的絮状沉淀。
(1)方法一所发生反应的化学方程式为_________________。
(2)检验方法一反应后所得溶液中是否含有NH4+的实验方法是_________________。
(3)方法二被冰水冷却的U 型管中所得物质是_________________,用冰水冷却的目的是_________________。
(4)方法一与方法二相比所具有的优点是_________________。
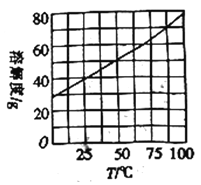
(5)方法一和方法二中均需用到NH4Cl,NH4Cl的溶解度随温度变化的曲线如右图所示,工业NH4Cl固体中含有少量的FeCl2,可通过如下实验来提纯:将工业NH4Cl固体溶于水,_________,调节溶液的pH为4~5,向溶液中加入活性炭,将溶液加热浓缩,________获得纯净的NH4Cl固体。(实验中可供选择的试剂有:双氧水、KMnO4溶液)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以软锰矿粉(主要含MnO2,还含有少量的Fe2O3、Al2O3等杂质)为原料制取高纯MnO2的流程如下:
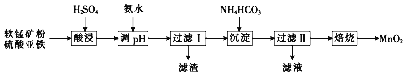
(1)酸浸时所发生主要反应的离子方程式为_____________。
(2)酸浸时加入一定体积的硫酸,硫酸浓度不能过小或过大。当硫酸浓度偏小时,酸浸时会有红褐色渣出现,原因是_______。硫酸浓度不能过大的原因是_____________。
(3)过滤Ⅱ所得滤渣为MnCO3,滤液中溶质的主要成分是_____。
(4)焙烧MnCO3的装置如下图所示:
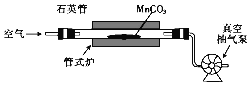
①焙烧时所发生反应的化学方程式为__________。
②焙烧一定时间后需转动石英管,目的是_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com