
��1����֪��2NO2(g) N2O4(g)����H��0���ں��º��������£���һ����NO2��N2O4�Ļ������ͨ���ݻ�Ϊ2L���ܱ������У���Ӧ�����и����ʵ����ʵ���Ũ��c��ʱ��t�ı仯��ϵ����ͼ��ʾ��
N2O4(g)����H��0���ں��º��������£���һ����NO2��N2O4�Ļ������ͨ���ݻ�Ϊ2L���ܱ������У���Ӧ�����и����ʵ����ʵ���Ũ��c��ʱ��t�ı仯��ϵ����ͼ��ʾ��

��a��b��c��d�ĸ����У���ʾ��ѧ��Ӧ����ƽ��״̬�ĵ��� ��
��ǰ10 min����N��2��ʾ�Ļ�ѧ��Ӧ����v(N��2)�� mol��L-1��min-1����Ӧ�ڵ�һ��ƽ����ƽ�ⳣ��K(1)�� �����÷�����ʾ������Ӧ�ڵڶ���ƽ����ƽ�ⳣ��K(2)���һ��ƽ����ƽ�ⳣ��K(1)�Ĺ�ϵ��K(2) K(1)�����������������������
��������ͼ�����л���1 mol N2O4ͨ��2L���ܱ������з�Ӧ���������е������仯ʾ��ͼ�����������Ϸֱ�����Ӧ���������Ļ�ѧʽ��

��2����ͼ��a��b��c��d�ֱ��������Ԫ�أ���A�壩��Te���ڣ���Se��������S�����⻯��ķ�Ӧ�ȵ�����ʾ��ͼ���Իش��������⣺

��������ɣ��ǽ���Ԫ���⻯����ȶ������γ��⻯��ķ�Ӧ�ȡ�H�Ĺ�ϵ ��
��д�������ⷢ���ֽⷴӦ���Ȼ�ѧ��Ӧ����ʽ�� ��
��1����b��d �� 0.04��1�֣� 10/9 ����1�֣�
�� ��
��
��2���ٷǽ���Ԫ���⻯��Խ�ȶ�����HԽС����֮��Ȼ����H2Se(g)��Se(s)��H2(g)�� ��H����81kJ/mol
��������
�����������1������ͼ��֪��10��25min��35min֮��X��Y�����ʵ����������仯������Ӧʱ����ڵĵ㴦�ڻ�ѧƽ��״̬����b��d���ڻ�ѧƽ��״̬���ʴ�Ϊ��b��d��
�ڸ��ݻ�ѧ��������ͼ��ı仯���ƿ�֪��X��ʾNO2Ũ����ʱ��ı仯���ߣ�Y��ʾN2O4Ũ����ʱ��ı仯���ߡ���ͼ��֪��ǰ10min�ڣ�NO2��Ũ�ȱ仯��Ϊ��0.6��0.2��mol/L��0.4mol/L�����Ԧ�(NO2)��0.4mol/L��10min��0.04mol•L-1•min-1������ͼ���֪����Ӧ�ڵ�һ��ƽ�����NO2��N2O4��Ũ�ȷֱ���0.6mol/L��0.4mol/L����÷�Ӧ��ƽ�ⳣ��K(1)�� ��
�� ��
�� ����25minʱNO2��Ũ������N2O4Ũ�Ȳ��䣬��˵���ı������һ�������¶ȣ�ֻ���������������Ũ�ȡ�ƽ�ⳣ��ֻ���¶��й�ϵ������ƽ�ⳣ�����䣬��K(2)��K(1)��
����25minʱNO2��Ũ������N2O4Ũ�Ȳ��䣬��˵���ı������һ�������¶ȣ�ֻ���������������Ũ�ȡ�ƽ�ⳣ��ֻ���¶��й�ϵ������ƽ�ⳣ�����䣬��K(2)��K(1)��
��NO2ת��ΪN2O4�ķ�Ӧ�Ƿ��ȷ�Ӧ�������������仯ʾ��ͼΪ ��
�� ��
��
��2���ٸ���ͼ���֪��Te���ڣ���Se��������S�����⻯��ķ�Ӧ�����ͣ����⻯����ȶ��������ߣ���˵���ǽ���Ԫ���⻯��Խ�ȶ�����HԽС����֮��Ȼ��
�ڸ���ͼ���֪��������ķ�Ӧ���ǣ�81kJ/mol�����������ⷢ���ֽⷴӦ�Ƿ��ȷ�Ӧ�������Ȼ�ѧ��Ӧ����ʽH2Se(g)��Se(s)��H2(g) ��H����81kJ/mol��
���㣺���鿼��ƽ��״̬���жϣ���Ӧ������ƽ�ⳣ���ļ������жϣ���Ӧ�ȵ�Ӧ�������



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
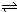 N2O4��g���ﵽƽ�⣮
N2O4��g���ﵽƽ�⣮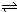 N2O4��g����ƽ�ⳣ��K��
N2O4��g����ƽ�ⳣ��K���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ���������и��������Ʊ����ռ���Ӧ�����壬�ɲ���������ͼ��ʾװ�ã�ͼ��β������װ���ԣ�����
���������и��������Ʊ����ռ���Ӧ�����壬�ɲ���������ͼ��ʾװ�ã�ͼ��β������װ���ԣ�����| �ŵ� | ��� |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com