
【题目】以下可逆反应,在给定的条件下一定达到了化学平衡状态的是 ( )
A.N2(g)+3H2(g)![]() 2NH3(g)[在混合气体中φ(NH3)=33.3%
2NH3(g)[在混合气体中φ(NH3)=33.3%
B.CO (g)+H2O(g)![]() CO2(g)+H2(g)(在恒容容器中,容器内压强不再改变
CO2(g)+H2(g)(在恒容容器中,容器内压强不再改变
C.2SO2(g)+O2(g)![]() 2SO3(g)(在恒压条件下,总质量不再改变
2SO3(g)(在恒压条件下,总质量不再改变
D.2NO2(g)![]() NO(g)+O2(g)(在恒容条件下,气体颜色不再改变
NO(g)+O2(g)(在恒容条件下,气体颜色不再改变
【答案】D
【解析】
试题分析:A.在混合气体中φ(NH3)=33.3%,不表示φ(NH3)不变化,可能是平衡建立过程中一种情况,不能说明达到了化学平衡状态,故A错误;B.CO(g)+H2O(g) ![]() CO2(g)+H2(g),反应前后气体的物质的量一直不变,在恒容容器中,容器内压强始终改变,不能说明达到了化学平衡状态,故B错误;C.2SO2(g)+O2(g)
CO2(g)+H2(g),反应前后气体的物质的量一直不变,在恒容容器中,容器内压强始终改变,不能说明达到了化学平衡状态,故B错误;C.2SO2(g)+O2(g) ![]() 2SO3(g),在恒压条件下,总质量始终不变,不能说明达到了化学平衡状态,故C错误;D.2NO2(g)
2SO3(g),在恒压条件下,总质量始终不变,不能说明达到了化学平衡状态,故C错误;D.2NO2(g) ![]() NO(g)+O2(g),在恒容条件下,气体颜色不再改变,表示二氧化氮的浓度不变,能够说明达到了化学平衡状态,故D正确;故选D。
NO(g)+O2(g),在恒容条件下,气体颜色不再改变,表示二氧化氮的浓度不变,能够说明达到了化学平衡状态,故D正确;故选D。


 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案科目:高中化学 来源: 题型:
【题目】碘化钠是实验室中常用的分析试剂,工业上用铁屑还原法制备NaI的流程如图所示。
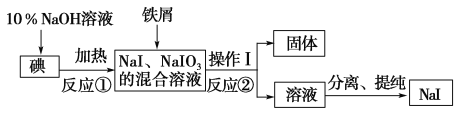
请回答下列问题:
(1)判断反应①中碘是否反应完全的方法是 。
(2)操作Ⅰ的名称是 。
(3)反应①的化学方程式为 。
(4)反应②中NaIO3被Fe单质还原为NaI,同时生成Fe(OH)3,写出该反应的化学方程式并用双线桥法表示此反应的电子转移的方向及数目
(5)在反应②中若有99 g NaIO3被还原,则转移电子的物质的量为 mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于乙烯的说法中错误的是
A.乙烯可以催熟植物的果实
B.乙烯生成聚乙烯的反应是乙烯分子互相加成反应
C.聚乙烯由乙烯聚合而成,故分子中含有很多碳碳双键
D.聚乙烯的单体是乙烯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数,下列说法正确的是( )
A. 22.4 L O2的质量约为32g
B. 17g NH3所含原子数为4NA,所含电子数为10NA
C. 标准状况下,22.4LH2O所含水分子为NA个
D. 0.5 mol/L Fe2(SO4)3 溶液中,SO42-的数目为1.5 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“神舟七号”的燃料是氢化锂三兄弟——LiH、LiD、LiT。其中Li的质量数为7,对这三种物质的下列说法正确的是
A. 质子数之比为1:2:3 B. 中子数之比为1:1:1
C. 摩尔质量之比为8:9:10 D. 化学性质不相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生产、生活密切相关,下列叙述正确的是
A.气象环境报告中新增的“PM2.5”是一种新的分子
B.光化学烟雾、硝酸型酸雨的形成均与氮氧化物有关
C.煤的干馏和液化均为物理变化
D.用活性炭为糖浆脱色和用次氯酸盐漂白纸浆的原理相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生产、生活息息相关,下列叙述错误的是( )
A.为防止电池中的重金属污染土壤和水体,应积极开发废旧电池的综合回收利用
B.氢能是清洁能源,工业上电解水法制大量氢气符合节能减排理念
C.大量的汽车尾气是造成雾霾天气的一个重要因素
D.煤的液化和气化均属于化学变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数,下面叙述正确的是 ( )
A.标准状况下,11.2L SO3所含分子数为0.5 NA
B.1L 1mol/L的氯化钠溶液中,所含离子数为NA
C.常温下,4.4g CO2和N2O(不反应)混合物中所含有的原子数为0.3 NA
D.一定量的铜与足量的浓硫酸反应,放出2.24L气体时,转移电子数为0.2 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na2S2O3俗称大苏打(海波)是重要的化工原料。用Na2SO3和硫粉在水溶液中加热反应,可以制得Na2S2O3。已知10℃和70℃时,Na2S2O3在100g水中的溶解度分别为60.0g和212g。常温下,从溶液中析出的晶体是Na2S2O3·5H2O。
现实验室欲制取Na2S2O3·5H2O晶体(Na2S2O3·5H2O的分子量为248)步骤如下:
①称取12.6g Na2SO3于烧杯中,溶于80.0mL水。
②另取4.0g硫粉,用少许乙醇润湿后,加到上述溶液中。
③(如图所示,部分装置略去),水浴加热,微沸,反应约1小时后过滤。
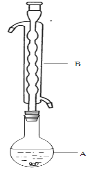
④滤液在经过 、 后析出Na2S2O3·5H2O晶体。
⑤进行减压过滤并干燥。
(1)仪器B的名称是________________。其作用是___________。加入的硫粉用乙醇润湿的目的是 。
(2)步骤④应采取的操作是 、 。
(3)滤液中除Na2S2O3和可能未反应完全的Na2SO3外,最可能存在的无机杂质是 。如果滤液中该杂质的含量不很低,其检测的方法是: 。
(4)为了测产品的纯度,称取7.40g 产品,配制成250mL溶液,用移液管移取25.00mL于锥形瓶中,滴加淀粉溶液作指示剂,再用浓度为0.0500mol/L 的碘水,用 (填“酸式”或“碱式”)滴定管来滴定(2S2O32- + I2 = S4O62- + 2I-),滴定结果如下:
滴定次数 | 滴定前读数(mL) | 滴定滴定后读数(mL) |
第一次 | 0.30 | 31.12 |
第二次 | 0.36 | 31.56 |
第三次 | 1.10 | 31.88 |
则所得产品的纯度为 ,你认为影响纯度的主要原因是(不考虑操作引起误差) 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com