
【题目】X、Y、Z三种气体,取X和Y按1∶1的物质的量之比混合,放入密闭容器中发生如下反应:X+2Y![]() 2Z,达到平衡后,测得混合气体中反应物的总物质的量与生成物的总物质的量之比为3∶2,则Y的转化率最接近于( )
2Z,达到平衡后,测得混合气体中反应物的总物质的量与生成物的总物质的量之比为3∶2,则Y的转化率最接近于( )
A. 33% B. 40% C. 50% D. 65%
科目:高中化学 来源: 题型:
【题目】电化学在日常生活中用途广泛,图甲是镁—次氯酸钠燃料电池,电池总反应为:Mg+ClO-+H2O=Cl-+Mg(OH)2↓,图乙是含Cr2O72-的工业废水的处理。下列说法正确的是( )
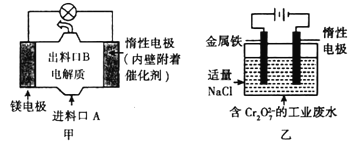
A. 图甲中发生的还原反应是Mg2++ClO-+H2O+2e-=Cl-+Mg(OH)2↓
B. 图乙中Cr2O72-向惰性电极移动,与该极附近的OH-结合,转化成Cr(OH)3除去
C. 图乙电解池中,若有0.84 g阳极材料参与反应,则阴极会有168 mL(标准状况)的气体产生
D. 若图甲燃料电池消耗0.36 g镁产生的电量用以图乙废水处理,理论上可产生1.07g氢氧化铁沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2CO(g)+O2(g)===2CO2(g) ΔH=-566 kJ·mol-1
Na2O2(s)+CO2(g)===Na2CO3(s)+![]() O2(g) ΔH=-226 kJ·mol-1
O2(g) ΔH=-226 kJ·mol-1
根据以上热化学方程式判断,下列说法正确的是( )
A. CO的燃烧热为283 kJ
B. 下图可表示由CO生成CO2的反应过程和能量关系

C. 2Na2O2(s)+2CO2(s)===2Na2CO3(s)+O2(g) ΔH>-452 kJ·mol-1
D. CO(g)与Na2O2(s)反应放出509 kJ热量时,电子转移数为6.02×1023
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室需配制0.5 mol·L-1的烧碱溶液500mL,根据配制的过程,完成填空:
(1)根据计算得知,所需NaOH固体用托盘天平称出的质量为___________g。
(2)配制溶液的过程中,有以下操作。其中正确的是___________ (填序号)。
A.将氢氧化钠固体放在纸片上称量
B.在烧杯中溶解氢氧化钠固体后,立即将溶液倒入容量瓶中
C.将溶解氢氧化钠的烧杯用蒸馏水洗涤2~3次,并将洗涤液转移到容量瓶中
D.定容时发现所配溶液超过刻度线,用胶头滴管吸取溶液使液面与刻度线相平
(3)玻璃棒在该实验中的作用有:
①_______________。
②_______________。
(4)若出现如下情况,对所配溶液浓度将有何影响(填“偏高”、“偏低”或“无影响”)?
①若没有将洗涤液转移到容量瓶的操作_______________;
②若加蒸馏水时不慎超过了容量瓶的刻度_______________;
③若定容时俯视刻度线_______。
④容量瓶中使用前有少量蒸馏水没有干燥_______。
(5)取所配溶液24.0 mL可以中和_______mL的12mol/L浓盐酸。标准状况下_______L的HCl气体溶于水可配成这种浓度的浓盐酸100 mL。
(6)计算填空:已知MnO2+4HCl (浓)![]() MnCl2+Cl2↑+2H2O。若用二氧化锰消耗此12mol/L 的浓盐酸100 mL制备氯气,理论上需要二氧化锰_______g,可以制得氯气在标准状况下的体积为_______L。该反应是否是氧化还原反应,请判断并说出理由_______。
MnCl2+Cl2↑+2H2O。若用二氧化锰消耗此12mol/L 的浓盐酸100 mL制备氯气,理论上需要二氧化锰_______g,可以制得氯气在标准状况下的体积为_______L。该反应是否是氧化还原反应,请判断并说出理由_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电渗析法是指在外加电场作用下,利用阴离子交换膜和阳离子交换膜的选择透过性,使部分离子透过离子交换膜而迁移到另一部分水中,从而使一部分水淡化而另一部分水浓缩的过程。如图是利用电渗析法从海水中获得淡水的原理图,已知海水中含Na+、Cl-、Ca2+、Mg2+、SO42-等离子,电极为石墨电极。下列有关描述错误的是

A.阳离子交换膜是A,不是B
B.通电后阳极区的电极反应式:2Cl――2e-→Cl2↑
C.工业上阴极使用铁丝网代替石墨碳棒,以增强导电性
D.阴极区的现象是电极上产生无色气体,溶液中出现少量白色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列反应中:
A.2F2+2H2O=4HF+O2 B.2Na+2H2O=2NaOH+H2↑
C.3NO2+H2O=2HNO3+NO D.2H2O![]() 2H2↑+O2↑
2H2↑+O2↑
其中水只作氧化剂的是________________,水只作还原剂的是________________,水既作氧化剂又作还原剂的是______________,水既不作氧化剂又不作还原剂的是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[2017北京节选]TiCl4是由钛精矿(主要成分为TiO2)制备钛(Ti)的重要中间产物,制备纯TiCl4的流程示意图如下:
![]()
(1)氯化过程:TiO2与Cl2难以直接反应,加碳生成CO和CO2可使反应得以进行。
已知:TiO2(s)+2Cl2(g)TiCl4(g)+ O2(g) ΔH1=+175.4 kJ·mol1
2C(s)+O2(g)2CO(g) ΔH2=220.9 kJ·mol1
① 沸腾炉中加碳氯化生成TiCl4(g)和CO(g)的热化学方程式:_______________________。
② 氯化过程中CO和CO2可以相互转化,根据如图判断:CO2生成CO反应的ΔH_____0(填“>”“<”或“=”),判断依据:________________________________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答问题。
(1)下列物质能导电且属于电解质的是___________(填序号)。
A.固态氯化钠 B.熔融氯化镁 C.盐酸 D.铝
(2)写出下列物质在水溶液中的电离方程式:KHSO4_______________。
(3)写出下列反应的离子方程式:
过量二氧化碳通入澄清石灰水中:__________________________________。
氢氧化钡溶液和硫酸反应:__________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com