
【题目】已知:2CO(g)+O2(g)===2CO2(g) ΔH=-566 kJ·mol-1
Na2O2(s)+CO2(g)===Na2CO3(s)+![]() O2(g) ΔH=-226 kJ·mol-1
O2(g) ΔH=-226 kJ·mol-1
根据以上热化学方程式判断,下列说法正确的是( )
A. CO的燃烧热为283 kJ
B. 下图可表示由CO生成CO2的反应过程和能量关系

C. 2Na2O2(s)+2CO2(s)===2Na2CO3(s)+O2(g) ΔH>-452 kJ·mol-1
D. CO(g)与Na2O2(s)反应放出509 kJ热量时,电子转移数为6.02×1023
【答案】C
【解析】A、燃烧热是1mol可燃物完全燃烧生成稳定氧化物时放出热量;已知:2CO(g)+O2(g)=2CO2(g)△H=-566kJ·mol-1,一氧化碳的燃烧热为283kJ·mol-1,故A错误;B、由热化学方程式,2CO(g)+O2(g)=2CO2(g)△H=-566kJ·mol-1,可知图象中一氧化碳和氧气物质的量为1、1/2,物质的量不符合反应物质的物质的量,故B错误;C、固体二氧化碳变化为气体二氧化碳需要吸热,焓变放热是负值,由2Na2O2(s)+2CO2(g)=2Na2CO3(s)+O2(g)△H=-226kJ·mol-1,所以反应2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(g)△H>-532 kJ·mol-1,故C正确;D、已知:①2CO(g)+O2(g)=2CO2(g)△H=-566kJ·mol-1;②Na2O2(s)+CO2(g)=Na2CO3(s)+1/2O2(g)△H=-226kJ·mol-1
依据盖斯定律②×2+①得到:2Na2O2(s)+2CO(g)=2Na2CO3(s)△H=-1018kJ·mol-1;即Na2O2(s)+CO(g)=Na2CO3(s)△H=-509kJ·mol-1;CO(g)与Na2O2(s)反应放出1/2×509 kJ=254.5kJ热量时,反应的一氧化碳物质的量为0.5mol,电子转移数为6.02×1023,故D错误;故选C。


科目:高中化学 来源: 题型:
【题目】按要求回答下列问题:![]()
(1)①反应类型______________
②反应类型________________
(2)现有如下有机物:
① CH3—CH3 ② CH2=CH2 ③ CH3CH2C![]() CH
CH
④ CH3C![]() CCH3 ⑤ C2H6 ⑥ CH3CH=CH2
CCH3 ⑤ C2H6 ⑥ CH3CH=CH2
一定互为同系物的是_______,一定互为同分异构体的是_______(填序号)
(3)人造羊毛的主要成分是聚丙烯腈(丙烯腈:CH2=CH—CN),试写出以乙炔、HCN为原料,两步反应合成聚丙烯腈的化学方程式。
①_________________________________
②_________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z的原子序数依次增大,其中部分元素在周期表中的位置如图所示。一个WX2分子中含有22个电子,Y的质子数是X、Z的核电荷数之和的—半。下列说法正确的是
W | X | |
Z |
A. 非金属性:W < Z
B. 简单离子的半径:X2- < Y2+
C. 沸点:H2X < H2Z
D. WX2的电子式为:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】做焰色反应实验用的铂丝,每试验一种样品后都必须进行的操作是( )
A. 用水洗涤2~3次后再使用
B. 用滤纸擦干后才可使用
C. 用盐酸洗涤后,再在酒精灯火焰上灼烧到没有颜色,才可使用
D. 用盐酸洗涤后,经蒸馏水冲洗,方可使用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某固体酸燃料电池以CsHSO4固体为电解质传递H+,其基本结构见下图。下列有关说法错误的是

A. a极为负极,电极上发生氧化反应
B. 电池总反应可表示为:2H2+O2=2H2O
C. 外电路中电子由b电极通过导线流向a电极
D. 该装置工作时把电能转化为化学能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.为了探究化学反应速率及其影响因素,某研究小组以盐酸和碳酸钙反应进行了如下实验。实验方案与数据如下表,t表示收集a mLCO2所需的时间。
序号 | 反应温度/℃ | C(HCl)/ mol·L-1 | V(HCl)/ mL | 10g碳酸钙的形状 | t/min |
1 | 20 | 2 | 10 | 块状 | t1 |
2 | 20 | 2 | 10 | 粉末 | t2 |
3 | 20 | 4 | 10 | 粉末 | t3 |
4 | 40 | 2 | 10 | 粉末 | t4 |
(1)设计实验1和实验2的目的是研究 _________________对化学反应速率的影响。
(2)为研究温度对对化学反应速率的影响,可以将实验_____和实验____(填序号)作对比。
(3)将实验2和实验3作对比,可知t2___________t3(填“﹥”、“﹤”或“﹦”)。
II.在一体积为10L密闭容器中,通入一定量的CO和H2O,在 850℃时发生如下反应:
CO(g)+H2O(g)![]() CO2(g)+H2(g),CO浓度变化如图,
CO2(g)+H2(g),CO浓度变化如图,

(1)则0~4 min的平均反应速率v(CO)=_____________mol·L-1·min -1。
(2)该反应达到最大限度所需的时间为____________,此时CO的转化率为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是周期表中短周期的一部分,若a原子最外层的电子数比次外层少了3个,则下列说法不正确的是

A. d的氢化物比b的氢化物稳定
B. d与c不能形成化合物
C. a、b、c的最高价氧化物对应水化物的酸性强弱的关系是c>b>a
D. 原子半径的大小顺序是a>b>c>d
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知甲、乙、丙、X是4种中学化学中常见的物质,其转化关系如图所示。

则甲和X不可能是
A. 甲为C,X为O2
B. 甲为SO2,X为NaOH溶液
C. 甲为Fe,X为Cl2
D. 甲为硝酸溶液,X为Fe
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温条件下起始时容积均为5L的甲、乙两密闭容器中(甲为恒容容器、乙为恒压容器),均进行反应:N2(g)+3H2(g)![]() 2NH3(g) △H2=-92.4kJ/mol ,有关数据及特定平衡状态见下表。
2NH3(g) △H2=-92.4kJ/mol ,有关数据及特定平衡状态见下表。
容器 | 起始投入 | 达平衡时 | ||
甲 | 2molN2 | 3molH2 | 0molNH3 | 1.5molNH3 |
乙 | amolN2 | bmolH2 | 0molNH3 | 1.2molNH3 |
(1)若平衡后同种物质的体积分数相同,起始时乙容器通入的N2的物质的量为 ,起始时乙中的压强是甲容器的 倍,乙的平衡常数为
(2)恒容密闭容器中可以发生氨气的分解反应,达平衡后,仅改变下表中反应条件x,下列各项中y随x的增大而增大的是 (选填序号)。
a | b | c | d | |
x | 温度 | 温度 | 加入H2的物质的量 | 加入氨气的物质的量 |
y | 混合气体的平均相对分子质量 | 平衡常数K | 混合气体的密度 | 达平衡时氨气的转化率 |
(3)研究在其他条件不变时,改变起始物氢气的物质的量对反应的影响,实验结果如图所示(图中T表示温度,n表示物质的量):
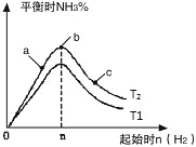
像中T2和T1的关系是:T2 T1(填“高于”“低于”“等于”“无法确定”)。
②a、b、c三点中,N2转化率最高的是 (填字母)。
③若容器容积为1L,T2℃在起始体系中加入1molN2,3molH2,经过5min反应达到平衡时H2的转化率为60%,则NH3的反应速率为 。保持容器体积不变,若起始时向容器内放入2molN2和6molH2,达平衡后放出的热量为Q,则Q_________110.88kJ(填“>”、“<”或“=”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com