
【题目】短周期元素W、X、Y、Z的原子序数依次增大,其中部分元素在周期表中的位置如图所示。一个WX2分子中含有22个电子,Y的质子数是X、Z的核电荷数之和的—半。下列说法正确的是
W | X | |
Z |
A. 非金属性:W < Z
B. 简单离子的半径:X2- < Y2+
C. 沸点:H2X < H2Z
D. WX2的电子式为:![]()
科目:高中化学 来源: 题型:
【题目】在我国南方,遭遇冰雪灾害时常使用一种融雪剂,其主要成分的化学式为XY2,X、Y均为元素周期表前20号元素,X的阳离子和Y的阴离子电子层结构相同,且1 mol XY2含有54 mol电子。
(1)该融雪剂的化学式是__________________,该物质中化学键类型是________________,电子式是__________________
(2)D、E元素原子的最外层电子数是其电子层数的2倍,D与Y相邻,则元素D的阴离子结构示意图是________________。D与E能形成一种结构类似于CO2的三原子分子,且每个原子均达到了8电子稳定结构,该分子的电子式为____________________。
(3)W是与D同主族的短周期元素,Z是第三周期金属性最强的元素,Z的单质与W的单质加热时生成物中化学键类型为__________,电子式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知以下信息:①1 mol N2的共价键断裂吸收946 kJ的能量;1 mol H2的共价键断裂吸收436 kJ的能量;形成1 mol NH3中的化学键释放1 173 kJ的能量。②将一定量的N2和H2投入一密闭容器中,在一定条件下进行反应,测得有关数据如下:
N2(mol·L-1) | H2(mol·L-1) | NH3(mol·L-1) | |
起始时 | 3 | 3 | 0 |
2s末 | 2.6 | 1.8 | 0.8 |
根据以上相关数据回答问题:
(1)用H2表示该反应2 s内的平均反应速率为________
(2)______(填“能”或“不能”)确认该反应2 s末已达化学平衡状态。
(3)写出该反应的化学方程式:
________________________________________________________________________。
(4)氮气和氢气生成氨气的过程______(填“释放”或“吸收”)能量。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中药药剂砒霜(主要成分As2O3,微溶于水)在医疗上用于治疗急性白血病。某课题组以一种含砷精矿石粉(主要成份为As4S4、As2S3、FeS2及其它惰性杂质)为原料制取As2O3, 工艺流程简图如下:

回答下列问题:
(1)过程I中所得SO2气体可回收再利用,下列有关SO2用途的说法正确的是______。
A.工业制硫酸 B.漂白纸张 C.自来水消毒
(2)过程II中发生的反应______氧化还原反应(填“是”或“不是”)。
(3)过程V中系列操作为_______ (填化学实验基本操作名称)。
(4)①过程I中焙烧As2S3的化学反应方程式为_______________。
②过程IV中生成As2O3的离子反应方程式为_______________。
(5)有毒的AsO33-通过电解反应可转化为无毒的AsO43-。用石墨为电极,在强碱性溶液中
电解含AsO33-的溶液,阳极的电极反应式为______________。
(6)测定某As2O3粗产品(含As2O5杂质)中As2O3的质量分数的实验过程如下:
a.称取m g粗产品溶解于NaOH溶液,得到含AsO33-、AsO43-的混合溶液l00mL。
b.分别移取25.00mL上述溶液,用0.02500 mol·L-1的I2标准溶液进行滴定(I2将AsO33-氧化为AsO43-,淀粉溶液为指示剂)。每次滴定开始时液面读数如图一所示,三次滴定结束时,I2标准溶液液面读数如图二图四所示。
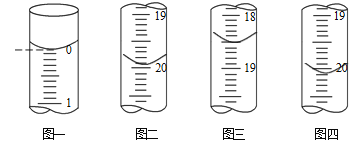
①描述滴定终点的现象_____________________。
②粗产品中As2O3的质量分数为______________ (用含有m的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】间溴苯甲醛(![]() ),是香料、染料、有机合成中间体,常温比较稳定,高温易被氧化。相关物质的沸点如下(101kPa)。
),是香料、染料、有机合成中间体,常温比较稳定,高温易被氧化。相关物质的沸点如下(101kPa)。
物质 | 沸点/℃ | 物质 | 沸点/℃ |
溴 | 58.8 | 1,2-二氯乙烷 | 83.5 |
苯甲醛 | 179 | 间溴苯甲醛 | 229 |
其实验室制备步骤如下:
步骤1:将三颈瓶中的一定配比的无水AlCl3、1,2-二氯乙烷和苯甲醛充分混合后,升温至60℃,缓慢滴加经浓硫酸干燥过的液溴,保温反应一段时间,冷却。
步骤2:将反应混合物缓慢加入一定量的稀盐酸中,搅拌、静置、分液。有机相用10%NaHCO3溶液洗涤。
步骤3:经洗涤的有机相加入适量无水MgSO4固体,放置一段时间后过滤。
步骤4:减压蒸馏有机相,收集相应馏分。(实验装置见下图)

(1)仪器A的名称为___________________,1,2-二氯乙烷的电子式为__________;
(2)实验装置中冷凝管的主要作用是________,进水口为____(填“a”或“b”);
(3)步骤1反应方程式为____________________;为吸收尾气锥形瓶中的溶液应为________,反应的离子方程式为________________;
(4)水浴加热的优点是__________________________;
(5)步骤2中用10%NaHCO3溶液洗涤有机相,是为了除去溶于有机相的______(填化学式);
(6)步骤4中采用减压蒸馏技术,是为了防止_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,①~⑩代表某元素,请回答以下问题:
主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
二 | ① | ② | ③ | |||||
三 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ||
四 | ⑩ |
(1)在①~⑩中,化学性质最不活泼的元素其原子结构示意图为___________;
(2)在①~⑩中,金属性最强的元素是_________(填元素符号),在化合物中均只显负价的元素是__________(填元素符号);
(3)在④~⑧中,元素的最高价氧化物对应的水化物中酸性最强的是__________(填物质化学式,下同),碱性最强的是________;
(4)在④~⑧中,原子半径最小的是__________(填元素符号),简单离子半径最小的是_______(填离子符号);
(5)在①、③、⑦、⑧元素的气态氢化物中最稳定的是__________(填氢化物化学式);
(6)写出工业上用①单质在高温条件制取⑦单质的化学方程式______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 共价化合物中可能含有离子键
B. Ca2+、K+、Cl-、S2-四种离子的半径依次减小
C. ![]() Po、
Po、![]() Po、
Po、![]() Po三种原子的核外电子数分别为124、125、126
Po三种原子的核外电子数分别为124、125、126
D. ⅥA族元素氧、硫、硒(Se)的位置从上至下,故H2O、H2S、H2Se稳定性依次减弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2CO(g)+O2(g)===2CO2(g) ΔH=-566 kJ·mol-1
Na2O2(s)+CO2(g)===Na2CO3(s)+![]() O2(g) ΔH=-226 kJ·mol-1
O2(g) ΔH=-226 kJ·mol-1
根据以上热化学方程式判断,下列说法正确的是( )
A. CO的燃烧热为283 kJ
B. 下图可表示由CO生成CO2的反应过程和能量关系

C. 2Na2O2(s)+2CO2(s)===2Na2CO3(s)+O2(g) ΔH>-452 kJ·mol-1
D. CO(g)与Na2O2(s)反应放出509 kJ热量时,电子转移数为6.02×1023
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于平衡常数K的说法中,正确的是
A.在任何条件下,化学平衡常数是一个恒定值
B.改变反应物浓度或生成物浓度都会改变平衡常数K
C.平衡常数K只与温度有关,与反应浓度、压强无关
D.从平衡常数K的大小不能推断一个反应进行的程度
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com