
分析 反应达到平衡状态时,正逆反应速率相等,平衡时各种物质的物质的量、浓度等不再发生变化,可由此根据化学平衡状态的特征进行判断.
解答 解:A、N2、H2、NH3的百分含量不再变化,说明各组分浓度不变,反应达到平衡状态,故A正确;
B、容器体积固定,反应前后气体物质的量不同,压强不变说明各组分浓度不变,反应达到平衡状态,故B正确;
C、各组分的分子数之比,不能判断各组分浓度是否变化,无法判断是否达到了平衡状态,故C错误;
D、各组分浓度大小,与加入多少以及反应程度有关,与平衡状态无关,故D错误;
E、化学平衡状态是正逆反应速率相等且不等于0的状态,故E错误;
F、v(N2)=v(H2),即不符合速率之比等于化学计量数之比也看不出正逆反应速率的关系,无法判断反应是否达到平衡状态,故F错误;
故答案为:AB.
点评 本题考查了化学平衡状态的判断,难度不大,注意反应达到平衡状态时,正逆反应速率相等,各组分浓度保持不变.


 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案 学习实践园地系列答案
学习实践园地系列答案科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
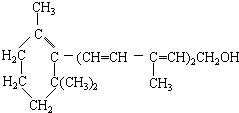
| A. | 维生素A分子含有氢原子数为奇数 | |
| B. | 维生素A的分子中含有苯环结构 | |
| C. | 1mol维生素A在催化剂作用下,可以和5molH2完全加成 | |
| D. | 维生素A属于醇,是一种水溶性维生素,可以发生消去反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 醋酸溶液的pH=a,将此溶液稀释1倍后,溶液的pH=b,则a>b | |
| B. | 在滴有酚酞溶液的氨水里,加入NH4C1至溶液恰好无色,则此时溶液的pH<7 | |
| C. | 物质的量浓度相等的CH3COOH和CH3COONa溶液等体积混合,c(CH3COO-)+2c(OH-)═2c(H+)+c(CH3COOH) | |
| D. | pH=5.6的CH3COOH与CH3COONa混合溶液中,c(CH3COO-)<c(Na+) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)铬的外围电子排布式是3d54s1,与铬同周期,最外层有3个未成对电子数的元素名称是砷,该元素对应的最低价氢化物分子的中心原子采取
(1)铬的外围电子排布式是3d54s1,与铬同周期,最外层有3个未成对电子数的元素名称是砷,该元素对应的最低价氢化物分子的中心原子采取| 元 素 | X | Y | Z |
| 电 负 性 | 1.5 | 1.2 | 1.8 |
| 第一电离能/kJ•mol-1 | 578 | 738 | 787 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | PH大小顺序①>④>③>② | |
| B. | C(NH3•H2O)大小顺序:②>④>③>① | |
| C. | 混合溶液④中存在C(NH3•H2O)+C(CO32-)+C(H+)=C(OH-)+C(H2CO3) | |
| D. | 混合溶液③中水的电离被促进,其中C(H+)和C(OH-)均大于1.0×10-7mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单质的化学活泼性:W<X<Y<Z | B. | 单质的氧化能力:W>X>Y>Z | ||
| C. | 原子最外层电子数:W<X<Y<Z | D. | 元素的最高化合价:W<X<Y<Z |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com