
| A、碳酸氢钠溶液中滴入氢氧化钙溶液:HCO3-+OH-=CO32-+H2O |
| B、二氧化硫通入次氯酸钠溶液:SO2+ClO-+2OH-=SO42-+Cl-+H2O |
| C、(NH4)2Fe(SO4)2溶液与过量NaOH溶液反应制Fe(OH)2:Fe2++2OH-=Fe(OH)2↓ |
| D、硅酸钠溶液与醋酸溶液混合:SiO32-+2H+=H2SiO3↓ |


 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:
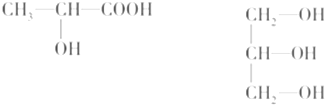
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,22.4 L氢气和氧气的混合气体,所含分子数为NA |
| B、物质的量浓度为0.5 mol?L-1的MgCl2溶液中,含有Cl-个数为 NA |
| C、常温常压下,1 mol氨气含有的原子数为4NA |
| D、1L含1 mol FeCl3溶液中Cl-的数目为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、红热的铜丝在氯气中剧烈燃烧,生成棕黄色烟 |
| B、钠在氯气中燃烧,生成白色的烟 |
| C、纯净的氢气在氯气中安静的燃烧,在集气瓶口形成白色烟雾 |
| D、氯气能与水反应生成盐酸和次氯酸,次氯酸见光易分解 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Fe3+、Mg2+、SO42-、NO3- |
| B、Ag+、Al3+、NO3-、OH- |
| C、Na+、Ba2+,Cl-、ClO- |
| D、K+、Na+、CO32-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
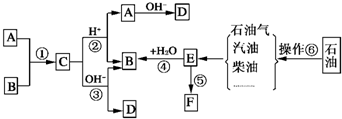 已知:A、B、F是家庭中常见的有机物,F常用于食品包装,E是石油化工发展水平的标志.根据下面转化关系回答问题.
已知:A、B、F是家庭中常见的有机物,F常用于食品包装,E是石油化工发展水平的标志.根据下面转化关系回答问题.查看答案和解析>>
科目:高中化学 来源: 题型:
| 操 作 | 现 象 |
| 取0.1mol/L的FeBr2溶液10mL,测溶液的pH | pH试纸变红(约为4) |
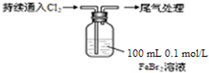 | ⅰ.开始通入100mL(折合标准状况),溶液由浅绿色逐渐变黄; ⅱ.稍后,继续通入Cl2,溶液黄色加深,变为棕黄色; iii.稍后,溶液由棕黄色变浅,最终变为黄色 |
| 试管 | 操作 | 现象 | 结论 |
| a | 取2mL FeCl2溶液,滴加少量氯水、2滴KSCN溶液,振荡 | Cl2的氧化性强于Fe3+ | |
| b | 取2mL FeCl3溶液,滴加少量溴化钠溶液和少量CCl4,振荡 | CCl4层没有明显变化 | |
| c | CCl4层由无色变为橙黄色 | Cl2的氧化性强于Br2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、.乙炔与与氯化氢反应制取氯乙烯 |
| B、乙烷和氯气反应制取氯乙烷 |
| C、.乙烯与氢气反应制取乙烷 |
| D、.乙烯通入溴水,溴水褪色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com