
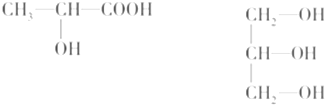
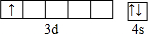
 ,其基态原子核外电子排布式为:1s22s22p63s23p63d14s2,原子序数为21,处于第四周期ⅢB族,属于金属元素,形成金属晶体,
,其基态原子核外电子排布式为:1s22s22p63s23p63d14s2,原子序数为21,处于第四周期ⅢB族,属于金属元素,形成金属晶体, ;1s22s22p63s23p63d14s2;21;金属;金属;
;1s22s22p63s23p63d14s2;21;金属;金属; ,故答案为:
,故答案为: .
.| 5-1×3 |
| 2 |


科目:高中化学 来源: 题型:
| A、k+ |
| B、Al3+ |
| C、SO42- |
| D、明矾溶于水后产生的氢氧化铝胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 电离能/kJ?mol-1 | I1 | I2 | I3 | I4 |
| A | 578 | 1817 | 2745 | 11578 |
| B | 738 | 1451 | 7733 | 10540 |
| c |
| ν |
| 共价键 | C-C | C-N | C-S |
| 键能/kJ?mol-1 | 347 | 305 | 259 |
| 离子晶体 | NaCl | KCl | CaO |
| 晶格能/kJ?mol-1 | 786 | 715 | 3401 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Cl2+2NaOH=NaCl+NaClO+H2O | ||||
B、2KClO3
| ||||
C、2KMnO4
| ||||
D、2H2O
|
查看答案和解析>>
科目:高中化学 来源: 题型:
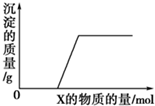 将溶液(或气体)X逐渐加入(或通入)到一定量的Y溶液中,产生沉淀的质量与加入X的物质的量关系如图所示,符合图中情况的一组物质是( )
将溶液(或气体)X逐渐加入(或通入)到一定量的Y溶液中,产生沉淀的质量与加入X的物质的量关系如图所示,符合图中情况的一组物质是( )| X | Y溶液 | |
| A | Ba(HCO3)2溶液 | NaOH溶液 |
| B | KOH溶液 | Mg(HSO4)2溶液 |
| C | Na2CO3溶液 | CaCl2溶液 |
| D | CO2气体 | 石灰水 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、9:3:1 |
| B、1:2:3 |
| C、3:2:1 |
| D、6:3:21 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、碳酸氢钠溶液中滴入氢氧化钙溶液:HCO3-+OH-=CO32-+H2O |
| B、二氧化硫通入次氯酸钠溶液:SO2+ClO-+2OH-=SO42-+Cl-+H2O |
| C、(NH4)2Fe(SO4)2溶液与过量NaOH溶液反应制Fe(OH)2:Fe2++2OH-=Fe(OH)2↓ |
| D、硅酸钠溶液与醋酸溶液混合:SiO32-+2H+=H2SiO3↓ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com