
| A、9:3:1 |
| B、1:2:3 |
| C、3:2:1 |
| D、6:3:21 |


科目:高中化学 来源: 题型:
| A、加入水时,平衡向逆反应方向移动 |
| B、加入少量NaOH固体,平衡向正反应方向移动 |
| C、通入少量HCl气体,溶液中PH值增大 |
| D、加入少量CH3COONa固体,平衡向正反应方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:
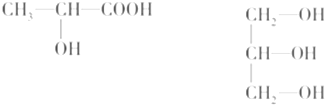
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、纳米材料直径一般在几纳米到几十纳米(1nm=10-9m)之间,因此纳米材料属于胶体 |
| B、青铜是我国使用最早的合金 |
| C、SiO2制成的玻璃纤维,由于导电能力强而被用于制造通讯光缆 |
| D、明矾与漂白粉都是水处理药品,原理相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,22.4 L氢气和氧气的混合气体,所含分子数为NA |
| B、物质的量浓度为0.5 mol?L-1的MgCl2溶液中,含有Cl-个数为 NA |
| C、常温常压下,1 mol氨气含有的原子数为4NA |
| D、1L含1 mol FeCl3溶液中Cl-的数目为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、红热的铜丝在氯气中剧烈燃烧,生成棕黄色烟 |
| B、钠在氯气中燃烧,生成白色的烟 |
| C、纯净的氢气在氯气中安静的燃烧,在集气瓶口形成白色烟雾 |
| D、氯气能与水反应生成盐酸和次氯酸,次氯酸见光易分解 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 操 作 | 现 象 |
| 取0.1mol/L的FeBr2溶液10mL,测溶液的pH | pH试纸变红(约为4) |
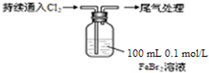 | ⅰ.开始通入100mL(折合标准状况),溶液由浅绿色逐渐变黄; ⅱ.稍后,继续通入Cl2,溶液黄色加深,变为棕黄色; iii.稍后,溶液由棕黄色变浅,最终变为黄色 |
| 试管 | 操作 | 现象 | 结论 |
| a | 取2mL FeCl2溶液,滴加少量氯水、2滴KSCN溶液,振荡 | Cl2的氧化性强于Fe3+ | |
| b | 取2mL FeCl3溶液,滴加少量溴化钠溶液和少量CCl4,振荡 | CCl4层没有明显变化 | |
| c | CCl4层由无色变为橙黄色 | Cl2的氧化性强于Br2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com