
| 电离能/kJ?mol-1 | I1 | I2 | I3 | I4 |
| A | 578 | 1817 | 2745 | 11578 |
| B | 738 | 1451 | 7733 | 10540 |
| c |
| ν |
| 共价键 | C-C | C-N | C-S |
| 键能/kJ?mol-1 | 347 | 305 | 259 |
| 离子晶体 | NaCl | KCl | CaO |
| 晶格能/kJ?mol-1 | 786 | 715 | 3401 |
| c |
| ν |
| hc |
| λ |
| 6.63×10-34×3×108×6.02×1023 |
| 300×10-9 |
| 5+3 |
| 2 |


 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案科目:高中化学 来源: 题型:
| A、甲苯通过硝化反应生成三硝基甲苯 |
| B、甲苯能使酸性高锰酸钾溶液褪色 |
| C、甲苯燃烧产生很浓的黑烟 |
| D、1 mol甲苯与3 mol氢气发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
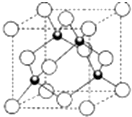 A、B、C都是元素周期表中的短周期非金属元素,它们的核电荷数依次增大.A原子的核外成对电子数是未成对电子数的2倍,B原子的最外层p轨道的电子为半满结构,C是地壳中含量最多的元素.D、E是第四周期元素,D原子核外最外层电子数有1个电子,其余各层电子均充满;E原子核外未成对电子数在同周期中最多.请用对应的元素符号或化学式填空:
A、B、C都是元素周期表中的短周期非金属元素,它们的核电荷数依次增大.A原子的核外成对电子数是未成对电子数的2倍,B原子的最外层p轨道的电子为半满结构,C是地壳中含量最多的元素.D、E是第四周期元素,D原子核外最外层电子数有1个电子,其余各层电子均充满;E原子核外未成对电子数在同周期中最多.请用对应的元素符号或化学式填空:查看答案和解析>>
科目:高中化学 来源: 题型:
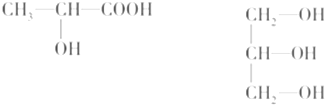
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、5mol |
| B、3 mol |
| C、5/3 mol |
| D、1 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Fe3+、Mg2+、SO42-、NO3- |
| B、Ag+、Al3+、NO3-、OH- |
| C、Na+、Ba2+,Cl-、ClO- |
| D、K+、Na+、CO32-、NO3- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com