
【题目】下列每组物质不能用分液漏斗分离的是
A. 苯和水 B. 四氯化碳和水 C. 汽油和水 D. 苯和溴苯
科目:高中化学 来源: 题型:
【题目】下列各组物质,按化合物、单质、混合物的顺序排列的是
A. 胆矾、液态氧、黑火药 B. 生石灰、白磷、熟石灰
C. 干冰、铁、氯化氢 D. 烧碱、氮气、冰水混合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是()
A. CO、NO、NO2都是大气污染气体,在空气中都能稳定存在,都不是酸性氧化物
B. N2+3H2![]() 2NH3、N2+O2
2NH3、N2+O2![]() 2NO都属于氮的固定,且N2都表现还原性
2NO都属于氮的固定,且N2都表现还原性
C. 向BaCl2溶液中加入Na2SO3产生沉淀,再通入NO2,沉淀完全溶解
D. 某无色溶液中加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,该溶液一定含有NH![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:A为淡黄色固体,T、R为两种常见的用途很广的金属单质,D是具有磁性的黑色晶体,H是白色沉淀,且在潮湿空气中迅速变为灰绿色,最终变为红褐色固体。
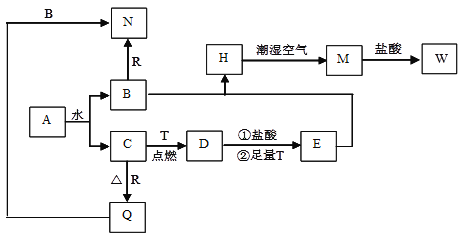
(1)写出下列物质的化学式A_______;D__________;N________。
(2)按要求写下列反应方程式:检验w中阳离子的离子方程式__________________________。
H在潮湿空气中变成M的化学方程式_________________________________。
D与盐酸反应的离子方程式_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿伏加德罗常数的值为NA.下列说法正确的是( )
A. 1L0.1molL﹣1NH4Cl溶液中,NH4+的数量为0.1NA
B. 2.4gMg与H2SO4完全反应,转移的电子数为0.1NA
C. 标准状况下,2.24LN2和O2的混合气体中分子数为0.2NA
D. 0.1mol H2和0.1mol I2于密闭容器中充分反应后,其分子总数为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)请用下列10种物质的序号填空:
①O2 ②H2 ③NH4NO3 ④K2O2 ⑤Ba(OH)2 ⑥CH4 ⑦CO2 ⑧NaF ⑨NH3 ⑩I2
其中既有离子键又有非极性键的是________;既有离子键又有极性键的是________。
(2)X、Y两种主族元素能形成XY2型化合物,已知XY2中共有38个电子,若XY2为常见元素形成的离子化合物,其电子式为_________;若XY2为共价化合物时,其结构式为______。
(3)氯化铝的物理性质非常特殊,如:氯化铝的熔点为190℃,但在180℃就开始升华。据此判断,氯化铝是________(填“共价化合物”或“离子化合物”),可以证明你的判断正确的实验依据____________________。
(4)现有a~g7种短周期元素,它们在周期表中的位置如图所示,请据此回答下列问题:
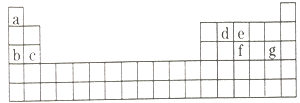
①元素的原子间反应最容易形成离子键的是________________。
A.c和f B.b和g C.d和g D.b和e
②写出a~g7种元素形成的所有原子都满足最外层为8电子结构的任意一种分子的分子式____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烧碱样品中含有少量不与酸作用的可溶性杂质,为了测定其纯度,进行以下滴定操作:
A.在250 mL容量瓶中配制250 mL烧碱溶液
B.用碱式滴定管量取25 mL烧碱溶液于锥形瓶中并加几滴甲基橙指示剂
C.在天平上准确称取烧碱样品w g,在烧杯中加蒸馏水溶解
D.将物质的量浓度为M mol/L的标准H2SO4溶液装入酸式滴定管,调整液面,记下开始刻度V1 mL
E.在锥形瓶下垫一张白纸,滴定到终点,记录终点刻度为V2 mL
回答下列问题:
(1)正确的操作步骤顺序中B前面是、D后面是(用字母填写).
(2)滴定读数应注意:滴定管与水平的实验台面 , 并使刻度线与滴定管液面的相切.
(3)操作D中液面应调整到的某一刻度.
(4)滴定到终点时锥形瓶内溶液的pH约为;终点时的颜色变化是 .
(5)若酸式滴定管没有用标准H2SO4润洗,会对测定结果有何影响
(6)该烧碱样品的纯度计算式是 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com