
以下有关原子结构及元素周期律的叙述正确的是
A.第IA族元素铯的两种同位素137Cs比133Cs多4个质子
B.同周期元素(除0族元素外)从左到右,原子半径逐渐减小
C.第 ⅦA元素从上到下,其氢化物的稳定性逐渐增强
D.同主族元素从上到下,单质的熔点逐渐降低
【解析】质子数相同而中子数不同的同一元素的不同原子互称为同位素,即137Cs和133Cs的质子数相同,137和133表示二者的质量数,因此A不正确;同周期元素(除0族元素外)从左到右,随着核电荷数的逐渐增多,原子核对外层电子对吸引力逐渐减弱,因此原子半径逐渐减小,B正确;同主族元素从上到下,随着核电荷数的逐渐增多,电子层数逐渐增多,原子半径逐渐增大,原子核对外层电子对吸引力逐渐减弱,非金属性逐渐减弱,因此第 ⅦA元素从上到下,其氢化物的稳定性逐渐减弱,C不正确;同主族元素从上到下,单质的熔点有的逐渐降低,例如IA,而有的逐渐升高,例如 ⅦA,所以选项也D不正确。
【答案】 B
B


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
将4.0 g NaOH固体溶于水配成100mL溶液,其密度为
0.20g/mL。
(1)该溶液中NaOH 的物质的量浓度为
(2)该溶液中NaOH的质量分数为
(3)从该溶液中取出10mL,其中NaOH的物质的量浓度为 ,含NaOH的质量为 。
(4)将取出的10mL溶液加水稀释到100mL,稀释后溶液中NaOH的物质的量浓度为
。
查看答案和解析>>
科目:高中化学 来源: 题型:
[化学——选修3:物质结构与性质](15分) 早期发现的一种天然二十面体准晶颗粒由Al、Cu、Fe三种金属元素组成。回答下列问题:
(1)准晶是一种无平移周期序,但有严格准周期位置序的独特晶体,可通过________方法区分晶体、准晶体和非晶体。
(2)基态Fe原子有________个未成对电子,Fe3+的电子排布式为______________________________,可用硫氰化钾检验Fe3+,形成的配合物的颜色为________。
(3)新制备的Cu(OH)2可将乙醛(CH3CHO)氧化成乙酸,而自身还原成Cu2O。乙醛中碳原子的杂化轨道类型为______________,1 mol乙醛分子中含有的σ键的数目为____________。乙酸的沸点明显高于乙醛,其主要原因是__________________________________。Cu2O为半导体材料,在其立方晶胞内部有4个氧原子,其余氧原子位于面心和顶点,则该晶胞中有________个铜原子。
(4)Al单质为面心立方晶体,其晶胞参数a=0.405 nm,晶胞中铝原子的配位数为________。列式表示Al单质的密度________________________________________________________________________g·cm-3
(不必计算出结果)。
查看答案和解析>>
科目:高中化学 来源: 题型:
图A所示的转化关系中(具体反应条件略),a、b、c和d分别为四种短周期 元素的常见单质,其余均为它们的化合物,i的溶液为常见的酸,a的一种同素异形体的晶胞如图B所示。
元素的常见单质,其余均为它们的化合物,i的溶液为常见的酸,a的一种同素异形体的晶胞如图B所示。
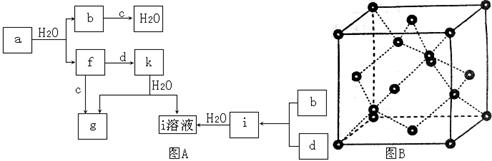
回答下列问题:
(1)图B对应的物质名称是 ,其晶胞中的原子数为 ,晶体类型为 。
(2)d中元素的原子核外电子排布式为 。
(3)图A中由二种元素组成的物质中,沸点最高的是 ,原因是 ,该物质的分子构型为 ,中心原子的杂化轨道类型为 。
(4)图A中的双原子分子中,极性最大的分子是 。
(5)k的分子式为 ,中心原子的杂化轨道类型为 ,属于 分子(填“极性”或“非极性”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
原子序数依次增大的短周期元素a、b、c、d和e中,a的最外层电子数为其周期数的二倍;b和d的A2B型氢化物均为V形分子,c的+1价离子比e的-1价离子少8个电子。
回答下列问题:
(1)元素a为________;c为________;
(2)由这些元素形成的双原子分子为________;
(3)由这些元素形成的三原子分子中,分子的空间结构属于直线形的是________,非直线形的是______________;(写2种)
(4)这些元素的单质或由它们形成的AB型化合物中,其晶体类型属于原子晶体的是________,离子晶体的是________,金属晶体的是________,分子晶体的是________;(每空填一种)
(5)元素a和b形成的一种化合物与c和b形成的一种化合物发生的反应常用于防毒面具中,该反应的化学方程式为_______________ _________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
原子序数小于36的X、Y、Z、W四种元素,其中X是形成化合物种类最多的元素,Y原子基态时最外层电子数是其内层电子数的2倍,Z原子基态时2p原子轨道上有3个未成对的电子,W的原子序数为29。
回答下列问题:
(1)Y2X2分子中Y原子轨道的杂化类型为 ,1mol Y2X2含有σ键的数目为 。
(2)化合物ZX3的沸点比化合物YX4的高,其主要原因是 。
(3)元素Y的一种氧化物与元素Z的一种氧化物互为等电子体,元素Z的这种氧化物的分子式是 。
(4)元素W的一种氯化物晶体的晶胞结构如图13所示,该氯化物的化学式是 ,它可与浓盐酸发生非氧化还原反应,生成配合物HnWCl3,反应的化学方程式为 。
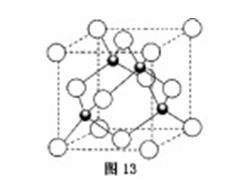
查看答案和解析>>
科目:高中化学 来源: 题型:
选做题,从以下两道题中任选一道做。
1.光催化制氢是化学研究的热点之一。科学家利用含有吡啶环(吡啶的结构式为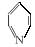 ,其性质类似于苯)的化合物Ⅱ作为中间体,实现了循环法制氢,示意图如下(仅列出部分反应条件):
,其性质类似于苯)的化合物Ⅱ作为中间体,实现了循环法制氢,示意图如下(仅列出部分反应条件):
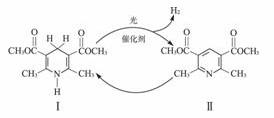
(1)化合物Ⅱ的分子式为________________________________________。
(2)化合物Ⅰ合成方法如下(反应条件略,除化合物Ⅲ的结构未标明外,反应式已配平):
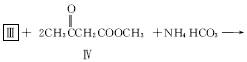
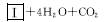
化合物Ⅲ的名称是_______________________。
(3)用化合物Ⅴ(结构式见下图)代替Ⅲ作原料,也能进行类似的上述反应,所得有机产物的结构式为____________________。
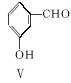
(4)下列说法正确的是________________(填字母)。
A.化合物Ⅴ的名称是间羟基苯甲醛,或2羟基苯甲醛
B.化合物Ⅰ具有还原性;Ⅱ具有氧化性,但能被酸性高锰酸钾溶液氧 化
化
C.化合物Ⅰ、Ⅱ、Ⅳ都可发生水解反应
D.化合物Ⅴ遇三氯化铁显色,还可发生氧化反应,但不能发生还原反应
(5)吡啶甲酸酯可作为金属离子的萃取剂。2吡啶甲酸正丁酯(Ⅵ)的结构式见下图,其合成原料2吡啶甲酸的结构式为__________________;Ⅵ的同分异构体中,吡啶环上只有一个氢原子被取代的吡啶甲酸酯类同分异构体有____________________种。
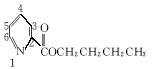
Ⅵ
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于元素的叙述正确的是
A.金属元素与非金属元素能形成共价化合物
B.只有在原子中,质子数才与核外电子数相等
C.目前使用的元素周期表中,最长的周期含有36种元素
D.非金属元素形成的共价化合物中,原子的最外层电子数只能是2或8
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com