
| A. | Na2S溶液:c(Na+)>c(HS-)>c(OH-)>c(H2S) | |
| B. | Na2C2O4溶液:c(OH-)=c(H+)+c(HC2O4-)+c(H2C2O4) | |
| C. | Na2CO3溶液:c(Na+)+c(H+)=2c(CO32-)+c(OH-) | |
| D. | CH3COONa和CaCl2混合溶液:c(Na+)+c(Ca2+)=c(CH3COO-)+c(CH3COOH)+2c(Cl-) |
分析 A.Na2S溶液中硫离子分步水解溶液显碱性;
B.Na2C2O4溶液中存在质子守恒,水电离出的氢氧根离子浓度和所有氢离子浓度存在形式总和相同;
C.碳酸钠溶液中存在电荷守恒,阴阳离子所带电荷数相同;
D.CH3COONa和CaCl2混合溶液中存在物料守恒,醋酸根离子和醋酸分子浓度总和和钠离子浓度相同,氯化钙溶液中氯离子浓度为钙离子浓度2倍.
解答 解:A.Na2S溶液中硫离子分步水解,S2-+H2O?HS-+OH-,HS-+H2O?H2S+OH-,溶液中离子浓度大小为:c(Na+)>c(OH-)>c(HS-)>c(H2S),故A错误;
B.Na2C2O4溶液中存在质子守恒:c(OH-)=c(H+)+c(HC2O4-)+2c(H2C2O4),故B错误;
C.碳酸钠溶液中存在电荷守恒,c(Na+)+c(H+)=2c(CO32-)+c(OH-)+c(HCO3-),故C错误;
D.CH3COONa和CaCl2混合溶液中存在物料守恒,醋酸根离子和醋酸分子浓度总和和钠离子浓度相同,氯化钙溶液中氯离子浓度为钙离子浓度2倍,CH3COONa和CaCl2混合溶液:c(Na+)+c(Ca2+)=c(CH3COO-)+c(CH3COOH)+2c(Cl-),故D正确;
故选D.
点评 本题考查了盐类水解、电解质溶液中质子守恒、电荷守恒和物料守恒的分析判断,注意混合溶液中物料守恒的应用,掌握基础是解题关键,题目难度中等.


科目:高中化学 来源: 题型:推断题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
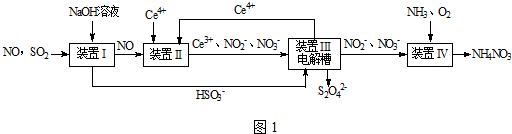
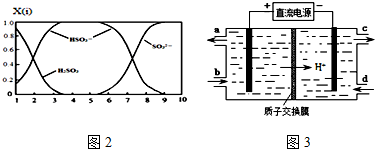
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝溶于NaOH溶液:Al+2OH-=[Al(OH)4]-+H2↑ | |
| B. | 稀盐酸与铁屑反应:Fe+2H+=Fe2++H2↑ | |
| C. | 碳酸镁中滴加稀盐酸:CO32-+2H+=CO2↑+H2O | |
| D. | 稀硫酸中滴加氢氧化钡溶液:H++OH-=H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 丙炔 | B. | 2-丁炔 | C. | 1-丁烯 | D. | 2-甲基丙烯 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com