
【题目】下列对热化学方程式:2SO2(g)+O2(g) ![]() 2SO3(g) ΔH1=-a kJ/mol(a>0)的描述,错误的是
2SO3(g) ΔH1=-a kJ/mol(a>0)的描述,错误的是
A. 该热化学方程式中,物质状态发生变化时,a值发生变化
B. 将方程式的系数缩小1/2,则新方程式的ΔH=1/2ΔH1
C. 该方程式的逆反应ΔH>0
D. 开始时充入2 mol SO2和1 mol O2,达平衡时,放出a kJ的热量
【答案】D
【解析】
由于物质本身具有的能量与物质的聚集状态有关,所以反应物和生成物的聚集状态不同,反应热△H的数值以及符号都可能不同。在热化学方程式中,化学方程式的系数表示的是物质的物质的量,所以可以是整数、分数、或小数。对相同化学反应,化学计量数不同,反应热△H也不同。在相同条件(温度、压强),相同物质的化学反应(互逆反应,不一定是可逆反应),正向进行的反应和逆向进行的反应,其反应热△H数值相等,符号相反。以此解题。
A. 该热化学方程式中,物质状态发生变化时,物质所具有的能量也会发生变化,反应热的数值a就会随之发生变化,A项正确;
B. 将方程式的系数缩小1/2,则新方程式中的反应热也会随着方程式的系数缩小1/2,因此ΔH=1/2ΔH1,B项正确;
C. 可逆反应中,对同一反应,正逆反应的反应热数值相等,符号相反,因此该方程式的逆反应ΔH>0,C项正确;
D. 开始时充入2 mol SO2和1 mol O2,因该反应可逆,不能进行彻底,因此达平衡时,反应放出的热量小于a kJ,D项错误;
答案应选D。


科目:高中化学 来源: 题型:
【题目】按要求回答问题:
(1)以Zn和Cu为电极,稀H2SO4为电解质溶液形成的原电池中:
①H+向___________极移动(填“正”或“负”)。
②电子流动方向由____________极流向____________极(填:“正”、“负”)。
③若有1mole- 流过导线,则理论上负极质量减少____________g。
④若将稀硫酸换成硫酸铜溶液,电极质量增加的是___________(填“锌极”或“铜极”),原因是_____________(用电极方程式表示)。
(2)一定温度下,在容积为2 L的密闭容器中进行反应:aN(g)![]() bM(g)+cP(g),M、N、P的物质的量随时间变化的曲线如图所示:
bM(g)+cP(g),M、N、P的物质的量随时间变化的曲线如图所示:

①反应化学方程式中各物质的系数比为a∶b∶c=_________。
②1 min到3 min这段时刻,以M的浓度变化表示的平均反应速率为: _____________。
③下列叙述中能说明上述反应达到平衡状态的是____________________________。
A.反应中当M与N的物质的量相等时
B.混合气体的总物质的量不随时间变化而变化
C.单位时间内每消耗amolN,同时消耗bmolM
D.混合气体的压强不随时间的变化而变化
E.M的物质的量浓度保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于pH变化的判断正确的是( )
A.温度升高,Na2CO3溶液pH减小B.温度升高,纯水pH增大
C.新制氯水经光照一段时间后,溶液pH减小D.氢氧化钠溶液久置于空气中,溶液pH变大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四氯化钛(TiCl4)是制取航天航空工业材料——钛合金的重要原料。由钛铁矿(主要成分是FeTiO3)制备TiCl4,同时获得副产品甲的工业生产流程如下:
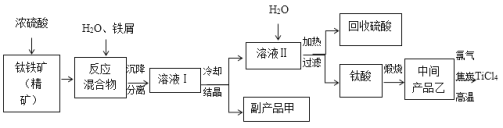
(1)已知酸浸反应FeTiO3+2H2SO4===FeSO4+TiOSO4+2H2O,则FeTiO3中铁元素的化合价为___________。
(2)上述生产流程中加入铁屑的目的是使Fe3+还原为Fe2+,且反应得到的溶液中含钛元素的离子只有TiO2+,该过程发生的主要反应有:
①2Fe3++Fe===3Fe2+ ; ②2TiO2++Fe+4H+===2Ti3++Fe2++2H2O;③______________________________________。
(3)加热TiOSO4溶液可制备TiO2·nH2O胶体,其反应的化学方程式为__________________。
(4)由TiO2·nH2O胶体制得固体TiO2·nH2O,再用酸清洗除去其中的Fe(OH)3杂质,还可制得钛白粉。已知25℃时,Ksp[Fe(OH)3]=2.79×10-39,该温度下反应Fe(OH)3+3H+![]() Fe3++3H2O的平衡常数K=___________________。
Fe3++3H2O的平衡常数K=___________________。
(5)可循环利用的物质是_________,副产品甲含结晶水,其化学式是_______________。
(6)依据下表信息,要精制含少量SiCl4杂质的TiCl4,可采用___________方法。
TiCl4 | SiCl4 | |
熔点/℃ | -25.0 | -68.8 |
沸点/℃ | 136.4 | 57.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】放热反应CO(g)+H2O(g)![]() CO2(g)+H2(g)在温度t1时达到平衡,c1(CO)=c1(H2O)=1.0 mol·L-1,其平衡常数为K1。升高反应体系的温度至t2时,反应物的平衡浓度分别为c2(CO)和c2(H2O),平衡常数为K2,则( )
CO2(g)+H2(g)在温度t1时达到平衡,c1(CO)=c1(H2O)=1.0 mol·L-1,其平衡常数为K1。升高反应体系的温度至t2时,反应物的平衡浓度分别为c2(CO)和c2(H2O),平衡常数为K2,则( )
A. K2和K1的单位均为mol·L-1
B. K2>K1
C. c2(CO)=c2(H2O)
D. c1(CO)>c2(CO)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是CO和水蒸气发生反应生成CO2和H2的途径和三个状态的能量,该反应为吸热反应,试问:
E1:CO+H2O![]() E2:C+2H+2O
E2:C+2H+2O![]() E3:CO2+H2
E3:CO2+H2
(1)步骤1、2分别是吸热过程还是放热过程?
步骤1:______,步骤2:______。
(2)比较E1、E3的大小______。
(3)已知,25℃时,C(石墨)+1/2O2(g) ═ CO(g) ΔH1=-111 kJ/mol;
H2(g)+1/2O2(g) ═ H2O(g) ΔH2=-242 kJ/mol;
C(石墨)+O2(g) ═ CO2(g) ΔH3=-394 kJ/mol。
则CO和H2O(g)反应的热化学方程式为:______。
(4)含1 mol Ba(OH)2的稀溶液与足量稀盐酸反应放出114.6 kJ的热量,写出该反应中和热的热化学方程式:______。
(5)在C2H2(g)完全燃烧生成CO2和液态水的反应中,每转移5NA个电子放出a kJ的热量。则表示C2H2的燃烧热的热化学方程式为:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数,下列说法正确的是
A. 162g淀粉和纤维素混合物中氧原子的数目为5NA
B. 常温时,pH=5的盐酸中水电离的OH-数目为10-9NA
C. 5mol的CH3COONa固体溶于水所得溶液中CH3COO-数目为5NA
D. 22.4L Cl2与足量的铁反应,转移的电子数目为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中需要配制2 mol/L的NaCl溶液950 mL,配制时应选用的容量瓶的规格和称取的NaCl质量分别是( )
A. 950 mL,111.2 g B. 500 mL,117 g
C. 1 000 mL,117 g D. 1 000 mL,111.2 g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com