

| 8×2+2-8 |
| 2 |
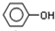 ,B为
,B为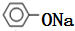 ,F为
,F为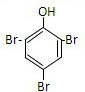 ,则A的结构简式为:
,则A的结构简式为: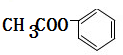 ,然后结合物质的结构和性质解答.
,然后结合物质的结构和性质解答.| 8×2+2-8 |
| 2 |
 ,B为
,B为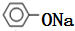 ,F为
,F为 ,则A的结构简式为:
,则A的结构简式为: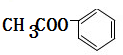 ,
, ,反应③为苯酚和浓溴水发生取代反应生成三溴苯酚沉淀,
,反应③为苯酚和浓溴水发生取代反应生成三溴苯酚沉淀,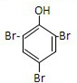 ,
, ;
;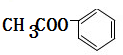 ,属于酯类的化合物且含有苯环结构的异构体有:①侧链可以为-OOCH和甲基,存在邻、间、对3种结构;②侧链可以为-COOCH3,存在1种结构,再加上A,属于酯类的A的满足条件的有机物总共有5种,
,属于酯类的化合物且含有苯环结构的异构体有:①侧链可以为-OOCH和甲基,存在邻、间、对3种结构;②侧链可以为-COOCH3,存在1种结构,再加上A,属于酯类的A的满足条件的有机物总共有5种,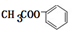 与氢氧化钠溶液反应生成苯酚钠、乙酸钠和水,反应的化学方程式为:
与氢氧化钠溶液反应生成苯酚钠、乙酸钠和水,反应的化学方程式为: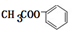 +2NaOH
+2NaOH| △ |
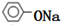 +CH3COONa+H2O,
+CH3COONa+H2O,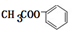 +2NaOH
+2NaOH| △ |
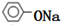 +CH3COONa+H2O.
+CH3COONa+H2O.


科目:高中化学 来源: 题型:
| 3 |
| 2 |
| 3 |
| 2 |
| 3 |
| 2 |
| A、-824.4kJ?mol-1 |
| B、-627.6kJ?mol-1 |
| C、-744.7kJ?mol-1 |
| D、-169.4kJ?mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、元素的性质随着原子的相对质量的递增而呈周期性变化的规律叫做元素周期律 |
| B、X2+的核外电子数目为18,则X在第三周期第ⅥA族 |
| C、因K比Na容易失去电子,所以金属性K比Na强 |
| D、Li、Na、K元素的原子随着核电荷数的增加核外电子层数减少 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:


 的名称为_
的名称为_查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质(杂质) | 除杂质所需试剂(要注明用量) | 离子方程式 |
| Fe?O?(Al?O?) | ||
| FeCl?溶液(FeCl?) | ||
| Na?CO?溶液(NaHCO?) | ||
| NaHCO?溶液(Na?CO?) |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com