
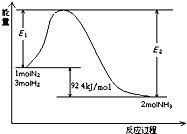
| T/K | 303 | 313 | 323 |
| NH3生成量/(10-6mol) | 4.8 | 5.9 | 6.0 |
| ||
| 5min |
| 0.3mol |
| 0.9mol |
(
| ||||
|


 名校通行证有效作业系列答案
名校通行证有效作业系列答案科目:高中化学 来源: 题型:
| A、Al和 NaOH溶液 |
| B、NaOH溶液和AlCl3溶液 |
| C、Na和O2 |
| D、NaOH溶液和CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
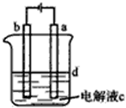
| A、a电极发生的电极反应:4OH--4e-=O2↑+2H2O |
| B、为了在较短时间内看到白色沉淀,可适当加大电压 |
| C、c可以是氯化钠溶液,d可以是苯 |
| D、为了在较短时间内看到白色沉淀,可以剧烈地搅拌溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)用l体积SO2和3体积空气混合,在450℃以上通过V2O5催化剂,发生如下反应:2SO2(g)+O2(g)?2SO3(g).一段时间后达到平衡,若此时同温同压下测得反应前后混合气体的密度比为0.9:1,则SO2平衡转化率为
(1)用l体积SO2和3体积空气混合,在450℃以上通过V2O5催化剂,发生如下反应:2SO2(g)+O2(g)?2SO3(g).一段时间后达到平衡,若此时同温同压下测得反应前后混合气体的密度比为0.9:1,则SO2平衡转化率为查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
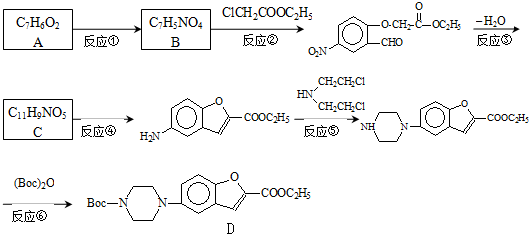
 ;
;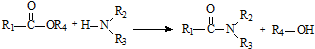 .
. 和
和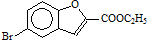 直接反应生成D,但实验中条件控制不当会发生副反应生成副产物,写出副产物有机物的结构简式
直接反应生成D,但实验中条件控制不当会发生副反应生成副产物,写出副产物有机物的结构简式查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com