
【题目】根据所学知识填空。
(1)根据分子中所含官能团可预测有机化合物的性质.
①下列有机化合物能发生消去反应的是(填字母).
a.CH3COOH b.CH3CH2OH c.CH3CH3
②下列有机化合物能与金属Na反应的是(填字母)
a.HCOOCH3 b.CH3CHO c. ![]()
③下列有机化合物能与溴水发生加成反应的是(埴字母)
a.CH3CH=CH2b. ![]() c.
c. 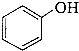
(2)苯乙烯( ![]() )常被用来制作一次性泡沫饭盒的材料聚苯乙烯.
)常被用来制作一次性泡沫饭盒的材料聚苯乙烯.
①苯乙烯是一种单体经过(填反应类型)反应合成聚苯乙烯.
②聚苯乙烯的结构简式为 .
③苯乙烯与溴的CCl4溶液反应后产物的结构简式为 .
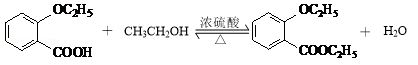
(3)由苯酚合成 ![]() 的流程如下(部分条件省略)
的流程如下(部分条件省略) 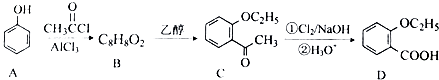
①已知:A→B反应生成B与HCl.写出有机物B的结构简式: .
②D与乙醇发生酯化反应的化学方程式为 .
③苯的衍生物X是C的一种同分异构体,能与NaHCO3溶液反应,苯环上含有2个取代基,且分子中只有4种不同化学环境的氢.写出X的一种结构简式 .
④检验物质D中是否含有A的试剂为 .
【答案】
(1)b;c;a
(2)加聚反应; ;
;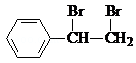
(3)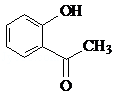 ;
; ;
; ;FeCl3溶液
;FeCl3溶液
【解析】解:(1)①连接醇羟基或卤原子的碳原子相邻碳原子上含有H原子的醇或卤代烃能发生消去反应,所以只有乙醇符合条件,能发生消去反应,故选b;②羧基和醇羟基能和Na反应生成氢气,这几种物质中只有c还有醇羟基,能和钠反应,故选c;③碳碳不饱和键能和溴发生加成反应,只有a中含有碳碳不饱和键,能和溴发生加成反应,c能和溴水发生取代反应,故选a;
(2.)①碳碳双键能发生加聚反应生成高分子化合物,苯乙烯中含有碳碳双键,所以能发生加聚反应生成聚苯乙烯,所以答案是:加聚反应;
②聚苯乙烯的结构简式为  ,所以答案是:
,所以答案是:  ;
;
③苯乙烯和溴能发生加成反应生成 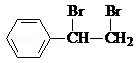 ,
,
所以答案是: 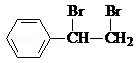 ;
;
(3.)A→B反应生成B与HCl,发生取代反应,B和乙醇发生取代反应生成C,根据C结构知,B结构简式为 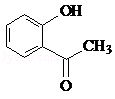 ,C发生取代反应生成D,
,C发生取代反应生成D,
①通过以上分析知,B结构简式为 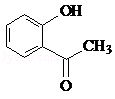 ,所以答案是:
,所以答案是: 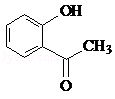 ;
;
②D与乙醇发生酯化反应的化学方程式为  ,
,
所以答案是: 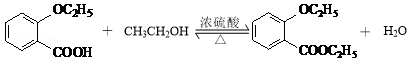 ;
;
③苯的衍生物X是C的一种同分异构体,能与NaHCO3溶液反应,说明含有羧基,苯环上含有2个取代基,且分子中只有4种不同化学环境的氢,则X的一种结构简式 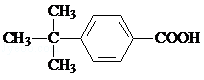 ,所以答案是:
,所以答案是: 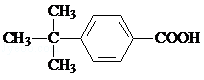 ;
;
④A中含有酚羟基、D中不含酚羟基,可以用氯化铁溶液检验酚羟基,所以检验物质D中是否含有A的试剂为
FeCl3溶液,所以答案是:FeCl3溶液.
【考点精析】认真审题,首先需要了解有机物的结构和性质(有机物的性质特点:难溶于水,易溶于汽油、酒精、苯等有机溶剂;多为非电解质,不易导电;多数熔沸点较低;多数易燃烧,易分解).


科目:高中化学 来源: 题型:
【题目】X,Y,Z,W是原子序数依次增大的短周期元素,Y,Z同周期且相邻,X,W同主族且与Y处于不同周期,Y,Z原子的电子数总和与X,W原子的电子数总和之比为5:4,下列说法正确的是( )
A.原子半径:r(W)>r(Z)>r(Y)>r(X)
B.Y的简单气态氢化物的热稳定性比Z的强
C.由X,Z组成的化合物与由Z,W组成的化合物只能发生化合反应
D.由X,Y,Z三种元素组成的化合物可以是酸、碱或盐
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子一定能在指定溶液中大量共存的是( )
A. ![]() =1×10-13 mol·L-1的溶液中:NH
=1×10-13 mol·L-1的溶液中:NH![]() 、Ca2+、Cl-、NO
、Ca2+、Cl-、NO![]()
B. 使酚酞变红色的溶液中:Na+、Al3+、SO![]() 、Cl-
、Cl-
C. 与Al反应能放出H2的溶液中:Fe2+、K+、NO![]() 、SO
、SO![]()
D. 水电离的c(H+)=1×10-13 mol·L-1的溶液中:K+、Na+、AlO![]() 、CO
、CO![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中不正确的是()
A.干冰升华要吸收大量的热,但不是化学反应中的吸热反应
B.酒精常被用做酒精灯和内燃机的燃料,说明酒精燃烧是放热反应
C.人们用氢氧焰焊接或切割金属,主要是利用了氢气和氧气化合时放出的能量
D.常温下不燃烧,加热才能燃烧,说明木炭燃烧是吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知CH3OH(l)的燃烧热为-726kJ·mol-1,对于反应2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(?)△H=-1452kJ·mol-1中水的状态判断正确的是
A.气态B.液态C.固态D.无法判断
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列操作会促进H2O的电离,且使溶液pH>7的是
A.将纯水加热到90 ℃B.向水中加少量NaOH溶液
C.向水中加少量Na2CO3溶液D.向水中加少量FeCl3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验误差分析错误的是
A. 用湿润的pH试纸测稀碱液的pH,测定值偏小
B. 用容量瓶配制溶液,定容时俯视刻度线,所配溶液浓度偏小
C. 滴定前滴定管内无气泡,终点读数时有气泡,所测体积偏小
D. 测定中和反应的反应热时,将碱缓慢倒入酸中,所测温度值偏小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组为了探究醋酸的电离情况,进行了如下实验:
【实验一】配制并标定醋酸溶液的浓度。取冰醋酸配制250 mL 0.2 mol·L-1的醋酸溶液,然后用0.2 mol·L-1的醋酸溶液稀释成所需浓度的溶液,再用NaOH标准溶液对所稀释的醋酸溶液的浓度进行标定。请回答下列问题:
(1)配制250 mL 0.2 mol·L-1醋酸溶液时需要用到的玻璃仪器有量筒、烧杯、玻璃棒、__________。
(2)为标定某醋酸溶液的准确浓度,用0.200 0 mol·L-1的NaOH溶液对20.00 mL醋酸溶液进行滴定,几次滴定消耗NaOH溶液的体积如下:
实验序号 | 1 | 2 | 3 | 4 |
消耗NaOH溶液 的体积(mL) | 20.05 | 20.00 | 18.40 | 19.95 |
则①滴定时选用________(A.石蕊 B.酚酞 C.不用指示剂 D.甲基橙)为指示剂(填字母)
②该醋酸溶液的准确浓度为________(保留小数点后四位)。
【实验二】探究浓度对醋酸电离程度的影响。用pH计测定25 ℃时不同浓度的醋酸溶液的pH,结果如下:
醋酸浓度 (mol·L-1) | 0.001 0 | 0.010 00 | 0.020 0 | 0.100 0 | 0.200 0 |
pH | 3.88 | 3.38 | 3.23 | 2.88 | 2.83 |
(3)根据表中数据,可以得出醋酸是弱电解质的结论,你认为得出此结论的依据是_________________。
(4)从表中的数据,还可以得出另一结论:随着醋酸浓度的减小,醋酸的电离程度______(填“增大”“减小”或“不变”)。
【实验三】探究温度对醋酸电离程度的影响。
(5)要完成该探究,需要用pH计(或pH试纸)测定 ___________________________。
【醋酸电离的应用】
(6)通过实验测定常温下醋酸的Ka=1×10-5,则0.1 mol·L-1醋酸钠溶液的pH=________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com