
【题目】下列各组物质中所含化学键类型完全相同的是
A. NaF、NH4Cl B. NaOH、NaClO C. CaO、Na2O2、 D. MgCl2、Mg(OH)2
科目:高中化学 来源: 题型:
【题目】现有0.284kg质量分数为10%的Na2SO4溶液.计算:
(1)溶液中Na2SO4的物质的量.
(2)溶液中Na+的物质的量.
(3)若将溶液稀释到2L,求溶液中Na+的物质的量浓度.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在反应KMnO4+HCl(浓)→MnCl2+KCl+Cl2↑+H2O中,
(1)配平上述化学方程式
(2)若生成35.5g Cl2 , 则被氧化的HCl是mol,转移的电子的物质的量是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.1 mol O2的质量为32g/mol
B.摩尔是国际单位制中的一个基本物理量
C.3.01×1023个CO2分子的质量为22g
D.H2O的摩尔质量为18g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示. 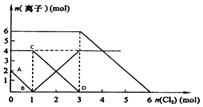
已知:
2Fe2++Br2═2Fe3++2Br﹣
2Fe3++2I﹣═2Fe2++I2
(1)Fe2+、I﹣、Br﹣的还原性由强到弱排列顺序为 .
(2)C→D代表离子浓度的变化.
(3)当通入1mol Cl2时,溶液中已发生的离子反应可表示为: .
(4)原溶液中:n(Fe2+):n(I﹣):n(Br﹣)=
(5)通入2mol Cl2时,溶液中已发生的离子反应可表示为: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.需加热才能发生的反应一定是吸热反应
B.任何放热反应在常温条件一定能发生反应
C.反应物和生成物分别具有的总能量决定了反应是放热反应还是吸热反应
D.当△H<0时表明反应为吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有25 ℃时0.1 mol·L-1的氨水,请回答以下问题:
(1)若向氨水中加入少量硫酸铵固体,此时溶液中 ![]() ________(填“增大”、“减小”
________(填“增大”、“减小”
或“不变”)。
(2)若向氨水中加入稀盐酸,使其恰好中和,写出反应的离子方程式:___________________;所得溶液的pH_____7(填“>”、“<”或“=”),用离子方程式表示其原因:_________________。
(3)若向该氨水中加入pH=1的盐酸,且氨水与盐酸的体积比为1∶1,则所得溶液中各离子物质的量浓度由大到小的顺序是_____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有五种可溶性物质A、B、C、D、E,它们所含的阴、阳离子互不相同,分别含有五种阳离子K+、Fe3+、Cu2+、Ba2+、Al3+、和五种阴离子Cl-、OH-、NO![]() 、CO
、CO![]() 、X中的一种。
、X中的一种。
(1)某同学通过比较分析得知,其中有两种物质的水溶液呈碱性,由此可判断这两种物质是__________和___________。
(2)物质C中含有离子X。为了确定X,现将(1)中的两种物质记为A和B,当 C与A的溶液混合时产生蓝色沉淀,向该沉淀中滴入足量稀HNO3,沉淀部分溶解,剩余白色固体,则X为________(填序号)。
A.Br- B.CH3COO- C.SO42- D.HCO3-
(3)将19.2gCu投入装有足量D溶液的试管中,Cu不溶解,再滴加稀H2SO4,Cu逐渐溶解,管口附近有红棕色气体出现,写出Cu溶解的离子方程式___________________________________,若要将Cu完全溶解,至少加入H2SO4的物质的量是___________________________。
(4)E溶液与氢碘酸反应时可生成棕色物质,该反应的离子方程式为:________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com