
| A. | C2H4 | B. | C6H6 | C. | BF3 | D. | NH3 |
分析 利用价层电子对互斥理论判断分子的空间构型,再判断键角,直线形的分子键角为180°,平面正六边形或平面三角形分子的键角为120°,三角锥形分子的键角为107°,据此分析.
解答 解:A.C2H4中C原子的价层电子对数为3,没有孤电子对,属于sP2杂化,为平面正三角形结构,键角为120°,故A不选;
B.C6H6的空间构型为平面正六边形,键角为120°,故B不选;
C.BF3中B原子价层电子对个数=3+$\frac{1}{2}$×(3-3×1)=0,B原子价层电子对个数为3且不含孤电子对,中心原子B是sP2杂化,所以为平面正三角形结构,键角为120°,故C不选;
D.NH3中N原子价层电子对个数=3+$\frac{1}{2}$×(5-3×1)=1,B原子价层电子对个数为3且含1个孤电子对,中心原子C是SP3杂化,所以为三角锥形结构,键角为107°,故D选;
故选D.
点评 本题考查了分子的空间构型和键角的判断,题目难度不大,注意根据价层电子对互斥理论判断分子的空间构型,根据空间构型判断键角,试题培养了学生的分析能力及灵活应用能力.


科目:高中化学 来源: 题型:推断题
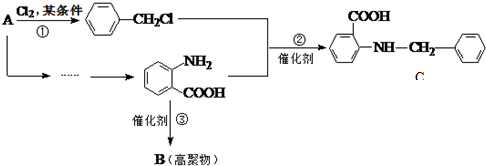
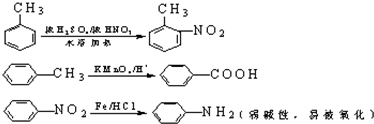
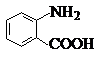 中官能团的名称氨基、羧基.
中官能团的名称氨基、羧基.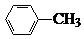 +Cl2$\stackrel{光}{→}$
+Cl2$\stackrel{光}{→}$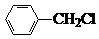 +HCl.
+HCl.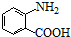 多一个碳的同系物,则满足下列条件的D的同分异构体共有19种,写出一种满足条件且含4种不同氢原子的同分异构体的结构简式
多一个碳的同系物,则满足下列条件的D的同分异构体共有19种,写出一种满足条件且含4种不同氢原子的同分异构体的结构简式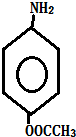 等.
等. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
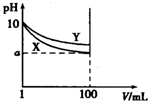 常温下,pH=10的X、Y两种碱溶液各1mL,分别稀释至100mL,其pH与溶液体积(V)的关系如图所示,下列说法正确的是( )
常温下,pH=10的X、Y两种碱溶液各1mL,分别稀释至100mL,其pH与溶液体积(V)的关系如图所示,下列说法正确的是( )| A. | X、Y两种碱溶液中溶质的物质的量浓度一定相等 | |
| B. | 稀释后,X溶液的碱性比Y溶液的碱性强 | |
| C. | 分别完全中和X、Y这两种碱溶液时,消耗同浓度盐酸 的体积Vx>Vy | |
| D. | 若8<a<10,则X、Y都是弱碱 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
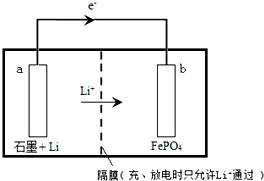 LiFePO4用于锂离子二次电池的电极材料,可由LiI和FePO4制备.
LiFePO4用于锂离子二次电池的电极材料,可由LiI和FePO4制备.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
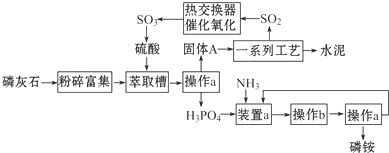
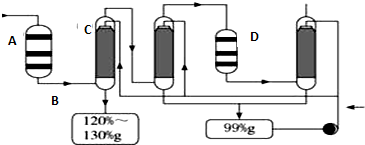
 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
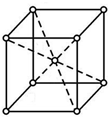 X、Y、Z、W四种元素是周期表前四周期元素,X元素原子核外有16种不同运动状态的电子,Y的原子序数比X大1,Z原子的M能层上有4个未成对电子,W的价层电子排布式为ndn+5(n+1)sn-1.
X、Y、Z、W四种元素是周期表前四周期元素,X元素原子核外有16种不同运动状态的电子,Y的原子序数比X大1,Z原子的M能层上有4个未成对电子,W的价层电子排布式为ndn+5(n+1)sn-1. ;W元素的名称为镍.
;W元素的名称为镍.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com