
| A. | NaCl晶体与冰 | B. | 石英与干冰 | C. | 金刚石与KCl晶体 | D. | 冰与干冰 |
分析 根据晶体的构成微粒和微粒间的作用力分析,离子晶体是阴阳离子间以离子键结合的晶体,分子晶体是分子间以分子间作用力结合形成的晶体,原子晶体是原子间以共价键结合形成的晶体.
解答 解:A、NaCl是离子晶体,冰(固态水)的构成微粒是分子,所以属于分子晶体,二者晶体类型不同,故A错误;
B、石英(SiO2)是原子晶体,干冰(固体CO2)为分子晶体,二者晶体类型不同,故B错误;
C、金刚石是原子晶体,KCl是离子晶体,二者晶体类型不同,故C错误;
D、冰(固态水)的构成微粒是分子,所以属于分子晶体,干冰(固体CO2)为分子晶体,二者晶体类型相同,故D正确;
故选D.
点评 本题考查了化学键类型和晶体类型的关系.判断依据为:离子晶体中阴阳离子以离子键结合,原子晶体中原子以共价键结合,分子晶体中分子之间以分子间作用力结合,题目难度不大.


科目:高中化学 来源: 题型:填空题
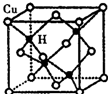 科学研究表明,铜锰氧化物(CuMn2O4)能在常温下催化氧化空气中的一氧化碳和甲醛(HCHO)
科学研究表明,铜锰氧化物(CuMn2O4)能在常温下催化氧化空气中的一氧化碳和甲醛(HCHO) .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硅单质可用来制造太阳能电池 | |
| B. | 装碱性溶液的玻璃试剂瓶不能用玻璃塞 | |
| C. | 二氧化硅是制造光导纤维的材料 | |
| D. | 自然界硅元素的贮量丰富,并存在大量的单质硅 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
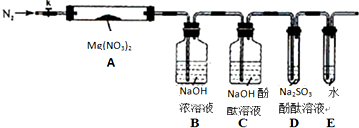
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NA个氧气分子与NA个氖气分子的质量比是4:5 | |
| B. | 17gOH-与19gH3O+所含电子数相等 | |
| C. | 32gSO2和40gSO3所含的原子数相等 | |
| D. | 标准状况下,11.2LCO2与常温常压下17gNH3所含分子数相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
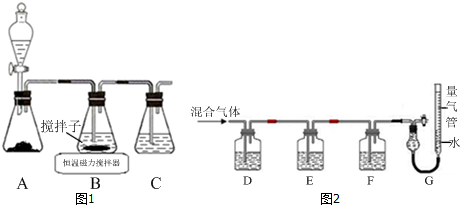
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
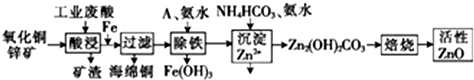
| 离子 | 开始沉淀时的pH | 完全沉淀时的pH |
| Fe2+ | 6.34 | 9.7 |
| Fe3+ | 1.48 | 3.7 |
| Zn2+ | 6.2 | 8.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
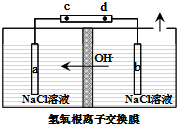 氯元素可以形成HClO、HClO2、HClO3、HClO4多种含氧酸.
氯元素可以形成HClO、HClO2、HClO3、HClO4多种含氧酸.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com