
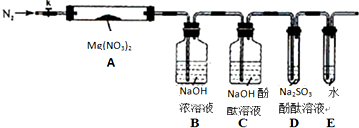
分析 实验探究Mg(NO2)2热分解的产物:实验前需要检验装置的气密性,连接仪器后,关闭k,微热硬质玻璃管A,观察到E中有气泡连续放出,证明装置气密性良好,加热前通入N2,利用氮气提供惰性环境,避免空气成分干扰,装置A:Mg(NO2)2热分解,装置B:A中出现的红棕色气体和浓氢氧化钠反应,2NO2+2NaOH=NaNO3+NaNO2+H2O,吸收二氧化氮,装置C:检验二氧化氮是否除尽,检验氨气存在,装置D:检验氧气存在,装置E:尾气吸收,防止空气中进入装置.
(1)选项中都涉及N元素的化合价的变化,为氧化还原反应,应满足氧化剂和还原剂得失电子数目相等,以此解答;
(2)①设法使装置内外形成气压差是气密性检查的常用手段,该题可利用封闭气体的热胀冷缩进行气密性检验;
②甲、乙、丙中都有氧气,避免空气中氧气干扰;根据加热试管的操作要求完成;
(3)①根据硝酸镁的反应现象结合固体质量差量法进行计算,确定固体的分解方式;
②D中亚硫酸钠具有还原性,能够和氧气反应生成硫酸钠,溶液褪色;二氧化氮和水和氧气生成硝酸,会消耗氧气.
解答 解:(1)Mg(NO2)2中氮元素化合价为+5价,而丁:MgO、NO2、N2,由于产物中氮元素NO2(+4价)、N2(0价),无其它化合价变化,为化合价只有降低情况,没有升高,不满足氧化还原反应的特征,
故答案为:不符合氧化还原反应原理(或只有化合价降低,无化合价升高);
(2)①该实验连接仪器后,利用封闭气体受热体积膨胀进行检验装置的气密性,方法为:关闭k,微热硬质玻璃管A,观察到E中有气泡连续放出,证明装置气密性良好,
故答案为:①关闭k,微热硬质玻璃管A,观察到E 中有气泡连续放出,停止加热后,有一段水柱回流入导管内,表明装置气密性良好;
②由于甲乙丙猜想中产物都有氧气,没有氮气,用氮气排出装置中空气避免对产物氧气检验的干扰,集中加热前先预热硬质试管,然后固定在管中固体部位下加热,
故答案为:避免对产物O2的检验产生干扰;移动酒精灯预热硬质玻璃管;
(3)①硝酸镁分解,红棕色气体是二氧化氮,镁元素不会还是硝酸镁形式,所以甲错误,称取Mg(NO3)2固体3.7g即0.025mol置于A中,测得剩余固体的质量为1.0g,则固体减少的质量是2.7g,硝酸镁的分解反应为:2Mg(NO3)2$\frac{\underline{\;\;△\;\;}}{\;}$2 MgO+4NO2↑+O2↑,乙正确,
故答案为:乙;
②亚硫酸钠和氧气的反应,反应方程式是:2Na2SO3+O2=2Na2SO4,小组讨论认定分解产物中有O2存在,未检测到的原因是,二氧化氮和水和氧气生成硝酸:4NO2+O2+2H2O=4HNO3,即O2在通过装置B时已参与反应,
故答案为:2Na2SO3+O2=2Na2SO4;O2在通过装置B时已参与反应(或其它合理答案).
点评 本题探究硝酸镁分解产物,提出假想,通过实验验证,涉及了化学方程式的书写、基本实验操作的考查等,本题难度中等,有利于提高学生运用所学知识的能力及化学实验能力.


科目:高中化学 来源: 题型:实验题
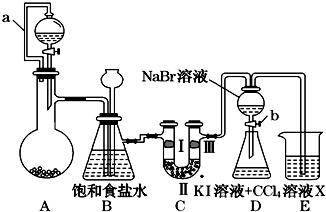
| ① | ② | ③ | ④ | |
| Ⅰ | 湿润的红纸条 | 干燥的红纸条 | 干燥的红纸条 | 湿润的红纸条 |
| Ⅱ | 碱石灰 | 浓硫酸 | 硅胶 | 氯化钠 |
| Ⅲ | 湿润的红纸条 | 干燥的红纸条 | 干燥的白纸条 | 干燥的红纸条 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验.
某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
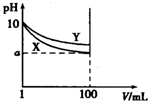 常温下,pH=10的X、Y两种碱溶液各1mL,分别稀释至100mL,其pH与溶液体积(V)的关系如图所示,下列说法正确的是( )
常温下,pH=10的X、Y两种碱溶液各1mL,分别稀释至100mL,其pH与溶液体积(V)的关系如图所示,下列说法正确的是( )| A. | X、Y两种碱溶液中溶质的物质的量浓度一定相等 | |
| B. | 稀释后,X溶液的碱性比Y溶液的碱性强 | |
| C. | 分别完全中和X、Y这两种碱溶液时,消耗同浓度盐酸 的体积Vx>Vy | |
| D. | 若8<a<10,则X、Y都是弱碱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在碱金属元素中,所有碱金属的氧化物均属于碱性氧化物 | |
| B. | 由于活泼性Na<K,故金属钾可以从NaCl 溶液中置换出钠单质 | |
| C. | 金属锂不能保存在煤油中,金属钾可以保存在煤油中 | |
| D. | 碱金属在自然界中都以游离态存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题


 .
. ;
; .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ;比较C和D的稳定性的强弱大小H2O>NH3(用化学式表示)
;比较C和D的稳定性的强弱大小H2O>NH3(用化学式表示)查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com